Pubblico la traduzione della ricerca integrale link alla fonte
Eventi avversi muscoloscheletrici nei cani trattati con bedinvetmab (Librela)
- 1 Ferguson Veterinary Clinic, Glenrothes, Regno Unito
- 2 Dipartimento di Chirurgia Ortopedica, Ospedale Universitario Balgrist, Zurigo, Svizzera
- 3 Vetoracle Teleradiology, Diss, Regno Unito
- 4 Clinica Veterinaria Castellarano, Castellarano, Italia
- 5 Davies Veterinary Specialists, Shillington, Regno Unito
- 6 Paragon Veterinary Referrals, Wakefield, Regno Unito
- 7 Chirurgia per piccoli animali Locum, PLLC, Dallas, TX, Stati Uniti
- 8 ESPEVET, Maiorca, Spagna
- 9 Vets Now Limited, Dunfermline, Regno Unito
- 10 Frank Pet Surgeons, Leeds, Regno Unito
- 11 Vita Referrals, Wetherby, Regno Unito
- 12 Texas Specialty Veterinary Services, Boerne, TX, Stati Uniti
- 13 The Moores Orthopaedic Clinic, Basingstoke, Regno Unito
- 14 referral specialistici di Hamilton, High Wycombe, Regno Unito
- 15 Perelman School of Medicine, Università della Pennsylvania, Philadelphia, PA, Stati Uniti
Obiettivi: Condurre un’analisi di disproporzionalità condotta da uno specialista delle segnalazioni di eventi avversi muscoloscheletrici (MSAER) nei cani trattati con bedinvetmab (Librela™) rispetto a sei farmaci di confronto con la stessa indicazione. Inoltre, riportare i risultati di un sottogruppo di cani i cui dati sugli eventi avversi (EA) sono stati sottoposti a valutazione indipendente da parte di un gruppo di esperti.
Disegno dello studio: studio caso-controllo e analisi di serie di casi.
Popolazione campione: database EudraVigilance dell’Agenzia europea per i medicinali (2004-2024) e 19 cani di proprietà dei clienti.
Metodi: Uno specialista veterinario in chirurgia EBVS® ha esaminato individualmente tutti i MSAER di Librela™, Rimadyl® , Metacam® , Previcox® , Onsior® , Galliprant® e Daxocox® ( 2004-2024). L’ipotesi nulla primaria era che il tasso di MSAER di Librela non avrebbe superato quello dei farmaci di confronto di oltre il 50%. L’ipotesi secondaria era che il MSAER avrebbe registrato un’impennata e una riduzione graduale in seguito al lancio di nuovi farmaci.
Risultati: L’analisi di disproporzionalità non ha supportato le ipotesi. Lesioni legamentose/tendinee, poliartrite, fratture, neoplasie muscoloscheletriche e artrite settica sono state segnalate con una frequenza circa 9 volte maggiore nei cani trattati con Librela rispetto al totale combinato dei cani trattati con i farmaci di confronto. Una revisione di 19 sospetti eventi avversi muscoloscheletrici (MSAE) condotta da un gruppo di esperti composto da 18 membri ha concluso all’unanimità che sussiste un forte sospetto di un’associazione causale tra bedinvetmab e distruzione articolare accelerata.
Conclusione: Questo studio supporta le recenti analisi della FDA, dimostrando un aumento del tasso di segnalazione di eventi avversi muscoloscheletrici nei cani trattati con Librela. Sono necessari ulteriori studi e un attento monitoraggio clinico dei cani trattati.
Impatto: i nostri risultati dovrebbero fungere da catalizzatore per indagini su larga scala sui rischi e sulla farmacovigilanza del bedinvetmab.
1 Introduzione
L’osteoartrite (OA) è la condizione di dolore cronico più diffusa negli animali da compagnia e contribuisce in modo significativo alla riduzione della qualità della vita e alla morte prematura ( 1 ). Sebbene attualmente sia disponibile una vasta gamma di approcci terapeutici, tutti presentano delle limitazioni, tra cui un’efficacia subottimale e il potenziale di gravi reazioni avverse. La gestione del dolore cronico è messa alla prova dal compromesso tra sicurezza ed efficacia. I farmaci analgesici che forniscono un significativo sollievo dal dolore possono comportare un rischio maggiore di reazioni avverse rispetto a opzioni più sicure e meno efficaci come gli integratori articolari a base di glucosamina-condroitina ( 2 ). Questo dilemma terapeutico è complicato dalle diverse percezioni del rischio tra veterinari e operatori sanitari. I veterinari, grazie alla loro formazione medica, potrebbero essere più a loro agio con i rischi associati agli analgesici prescritti, mentre gli operatori sanitari potrebbero essere più esitanti, a volte rifiutandone o limitandone l’uso anche quando ritenuto necessario dal veterinario ( 3 ). Questa disconnessione è sottolineata da uno studio del 2018 che rivela che il 22% dei cani a cui i veterinari avevano raccomandato analgesici non li hanno ricevuti ( 4 ).
Lo sviluppo di nuove terapie che offrano maggiore sicurezza ed efficacia può contribuire a colmare il divario tra le raccomandazioni dei veterinari e l’accettazione da parte degli operatori sanitari. Bedinvetmab (Librela™), un anticorpo monoclonale (mAb) diretto contro il fattore di crescita nervoso (NGF), rappresenta un significativo progresso nella gestione del dolore causato dall’osteoartrite (OA) canina. Dopo l’approvazione da parte della Commissione Europea nel novembre 2020, è diventato il primo mAb autorizzato per questa indicazione. La Food and Drug Administration (FDA) ha concesso l’autorizzazione all’immissione in commercio negli Stati Uniti 2 anni e mezzo dopo, e l’Australian Pesticides and Veterinary Medicines Authority ha successivamente registrato lo stesso farmaco con il nome di Beransa™.
Mentre queste approvazioni normative hanno sottolineato la fiducia mondiale negli anticorpi monoclonali veterinari, il loro equivalente umano è stato associato a sostanziali preoccupazioni sulla sicurezza. Nello specifico, l’NGF modula il turnover osseo e cartilagineo ( 5 ) e la sua inibizione è collegata all’accelerazione della degenerazione articolare negli esseri umani ( 6 , 7 ). Ciò è stato dimostrato nel 2012, quando gli studi clinici sugli anticorpi monoclonali anti-NGF (aNGFmAb) hanno rivelato un’osteoartrite rapidamente progressiva (RPOA) ( 8 ), portando la FDA a imporre una sospensione di due anni degli studi clinici e a rendere obbligatoria una strategia di valutazione e mitigazione del rischio (REMS) dopo la sospensione. Tuttavia, anche con uno screening rigoroso, un basso dosaggio e il divieto di FANS dopo l’implementazione della REMS, il rischio di RPOA persisteva ( 9-11 ) . Mentre il meccanismo esatto è ancora in fase di studio, gli studi clinici sull’uomo non hanno supportato l’ipotesi che l’RPOA sia causata dall’uso eccessivo delle articolazioni portanti ( 7 , 10 ).
La farmacovigilanza post-marketing è fondamentale per monitorare costantemente la sicurezza e l’efficacia di un farmaco dopo la sua immissione in commercio, poiché gli studi clinici non possono catturare l’intero spettro di potenziali reazioni avverse. Essa prevede una combinazione di segnalazione volontaria delle reazioni avverse ai farmaci (ADR) da parte di operatori sanitari e del pubblico, e programmi di sorveglianza proattiva, tra cui ricerche finanziate dal governo, sponsorizzate dall’industria e indipendenti. I risultati di tali attività guidano le decisioni normative, che possono variare da aggiornamenti delle etichette e restrizioni d’uso limitate fino, in rari casi, al ritiro dal mercato se i rischi superano i benefici ( 12 ).
Quando un animale manifesta segni clinici inattesi a seguito della somministrazione di un farmaco, può essere complesso differenziare questi effetti dalla malattia di base o da una nuova condizione non correlata. Ciononostante, l’identificazione tempestiva delle potenziali relazioni causali è fondamentale per garantire la sicurezza del paziente. La tragedia della talidomide esemplifica l’importanza cruciale di una rigorosa sorveglianza preclinica e post-marketing della sicurezza dei farmaci. Test insufficienti e la mancanza di solidi sistemi di sorveglianza post-marketing non sono riusciti a identificare il potenziale teratogeno della talidomide ( 13 ). Ciò ha portato a un uso diffuso del farmaco, con conseguenti gravi difetti alla nascita in migliaia di bambini, evidenziando le conseguenze potenzialmente devastanti del riconoscimento ritardato degli eventi avversi correlati al farmaco.
Nel dicembre 2024, la FDA ha emesso una lettera aperta ai veterinari, avvisandoli dei segnali di sicurezza neurologici e muscoloscheletrici identificati durante la sorveglianza post-marketing di Librela ( 14 ). Il Centro per la Medicina Veterinaria (CVM) della FDA ha utilizzato un approccio algoritmico per valutare le ADR. Il loro approccio, che incorpora l’analisi di sproporzionalità, ha valutato statisticamente la frequenza degli eventi avversi (EA) segnalati nei cani trattati con Librela rispetto a quelli trattati con altri farmaci per l’OA. L’analisi della FDA ha identificato 18 distinti segnali di sicurezza nei cani a cui è stato somministrato Librela, tra cui eventi neurologici, problemi urinari e disturbi muscoloscheletrici ( 14 ). In particolare, la FDA ha osservato un tasso di segnalazione sproporzionatamente elevato di “zoppia” nei cani a cui è stato somministrato Librela. In risposta, il Centro per la Medicina Veterinaria (CVM) ha consigliato ai veterinari di informare proattivamente i proprietari di animali domestici su queste potenziali reazioni avverse ( 14 ).
Il CVM ha sottolineato che il proprio obiettivo era quello di generare ipotesi, riconoscendo i limiti intrinseci nello stabilire una causalità definitiva ( 14 ). Hanno osservato che i sistemi di segnalazione degli eventi avversi (AE) sono soggetti a vari bias, tra cui la sottostima, bias di segnalazione influenzati dall’attenzione dei media [sociali] e fattori confondenti come i farmaci concomitanti. Inoltre, l’affidamento del CVM ad analisi algoritmiche di dati secondari, senza il beneficio dell’interpretazione clinica di esperti, introduce ulteriore incertezza diagnostica ( 15 ). Per affrontare questa limitazione, abbiamo utilizzato un approccio a due punte. In primo luogo, abbiamo condotto un’analisi di sproporzionalità condotta da specialisti delle segnalazioni di eventi avversi muscoloscheletrici (MSAER) per ampliare il lavoro del CVM. Questa analisi ha testato l’ipotesi nulla secondo cui il tasso di MSAER di Librela non avrebbe superato di oltre il 50% quello di sei farmaci di confronto con la stessa indicazione. In secondo luogo, riportiamo i risultati di un sottoinsieme di cani i cui dati sugli eventi avversi (AE) sono stati sottoposti a valutazione indipendente da parte di un gruppo di esperti e successivamente inviati all’Agenzia europea per i medicinali (EMA).
2 Materiali e metodi
2.1 Analisi di sproporzionalità MSAER
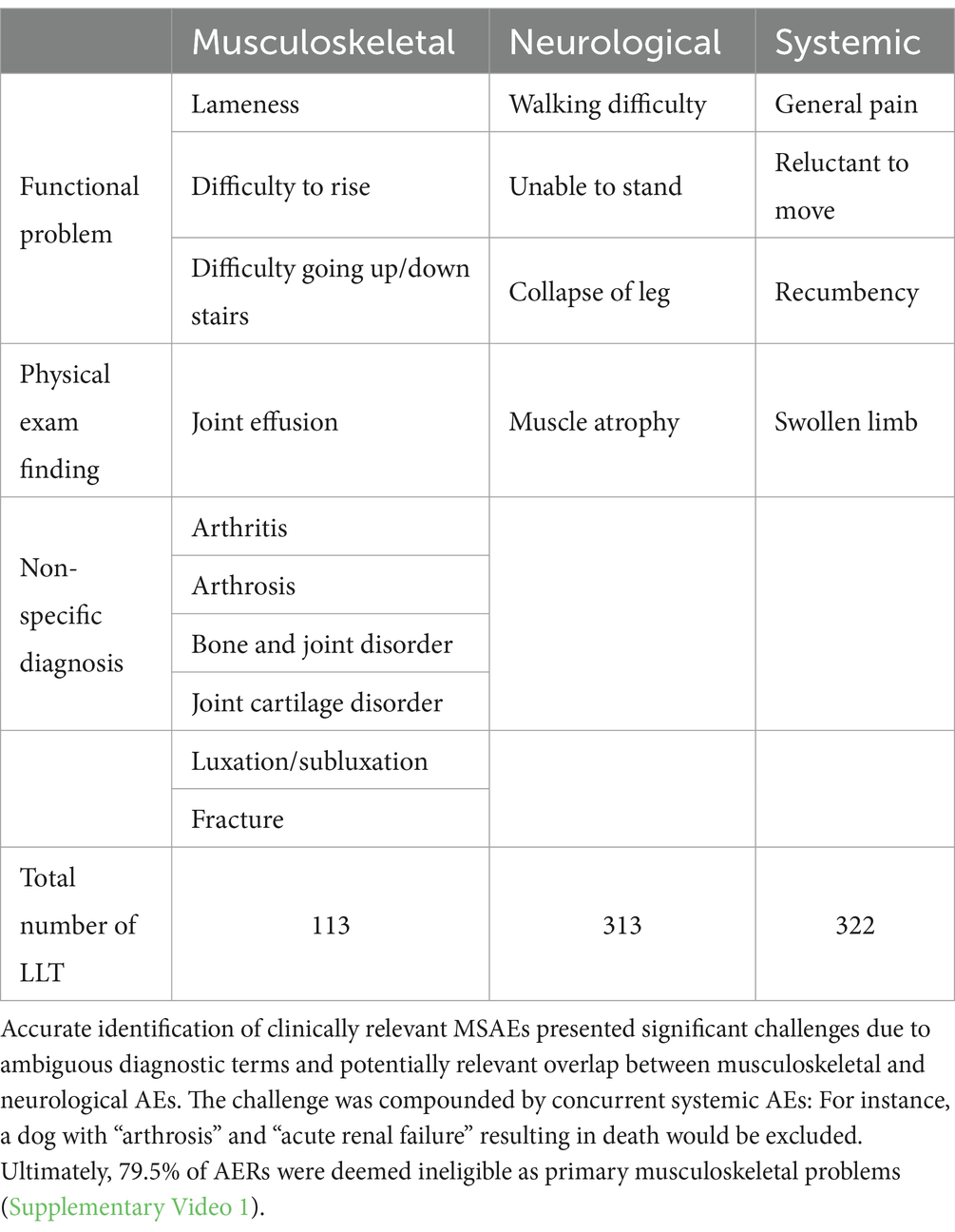
Una descrizione dettagliata dell’analisi del database EudraVigilance (EVD) è fornita nel Video supplementare 1. In breve, l’identificazione accurata degli eventi avversi muscoloscheletrici clinicamente rilevanti (MSAE) richiedeva una conoscenza approfondita del flusso di informazioni del sistema di farmacovigilanza ( Figura 1 ) e delle limitazioni intrinseche del sistema. Nello specifico, i termini diagnostici inviati dai segnalatori primari vengono pubblicati solo se elencati nel Dizionario veterinario per le attività di regolamentazione dei farmaci (VeDDRA). In caso contrario, il titolare dell’autorizzazione all’immissione in commercio (AIC; Zoetis, Louvain-la-Neuve, Belgio) seleziona un termine diagnostico da un elenco predefinito che include segni clinici (ad esempio, zoppia), diagnosi non specifiche (ad esempio, artrite) e diagnosi specifiche (ad esempio, rottura del legamento) ( 16 ). Al momento dell’analisi, VeDDRA conteneva 113 diagnosi di AE muscoloscheletriche e 313 neurologiche (ovvero, termini di basso livello, LLT) ( 16 ). Molti LLT presentano sovrapposizioni clinicamente rilevanti ( Tabella 1 ). Ad esempio, “debolezza degli arti” (un LLT muscoloscheletrico) può indicare un problema neurologico, mentre “collasso di una gamba” (un LLT neurologico) potrebbe descrivere un evento avverso ortopedico. Con oltre 35.000 possibili combinazioni di LLT muscoloscheletrici e neurologici, un semplice approccio algoritmico non è stato considerato fattibile.
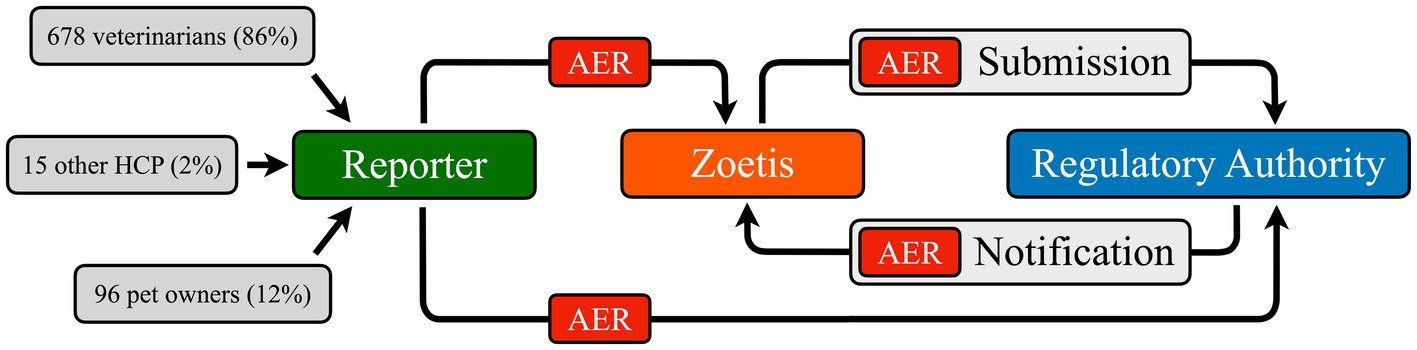
Per garantire la coerenza e tenere conto dei complessi giudizi clinici richiesti per l’interpretazione dei dati, un singolo specialista in chirurgia EBVS® ( Autore 1) ha esaminato le segnalazioni di eventi avversi muscoloscheletrici (MSAER) registrate nel database EudraVigilance (EVD) dell’Agenzia Europea per i Medicinali (EMA) dalla sua creazione nel 2004 al 31 dicembre 2024. È stata utilizzata un’analisi di disproporzionalità descrittiva per confrontare l’incidenza di MSAER associata a Librela con quella di altri sei analgesici veterinari: Rimadyl® , Metacam® , Previcox® , Onsior® , Galliprant® e Daxocox® . Questa analisi mirava a identificare eventuali tendenze temporali potenziali nelle segnalazioni di MSAER, in particolare a seguito dell’introduzione di nuovi farmaci. Tutte le segnalazioni di eventi avversi (AER) sono archiviate nell’EVD con i nomi commerciali; pertanto, i nomi commerciali sono utilizzati in modo coerente in tutto il manoscritto.
2.2 Criteri di inclusione delle serie di casi
Questo studio ha utilizzato uno schema retrospettivo di serie di casi. Il reclutamento dei casi è stato avviato dall’Autore 1 in seguito all’osservazione di un caso sospetto di RPOA in un cane trattato con Librela. Il caso è stato condiviso su un forum veterinario specialistico ( 17 ). Successivamente, nell’arco di un periodo di 11 mesi, diversi medici iscritti al forum hanno contattato l’Autore 1 per condividere le proprie preoccupazioni riguardo a gravi MSAE nei cani trattati con Librela. Sulla base di queste comunicazioni, è stato formato un gruppo di lavoro indipendente composto da medici con esperienza diretta di MSAE (vedere di seguito). L’obiettivo primario era indagare una potenziale associazione tra la somministrazione di Librela e la patologia osservata. Data la mancanza di precedenti casi di RPOA nei cani, il gruppo di lavoro ha chiesto consiglio a un esperto in neuro-osteoartropatia umana (Autore 2) e a due specialisti EBVS® in Diagnostica per Immagini con esperienza pubblicata in imaging muscoloscheletrico (Autori 3 e 4).
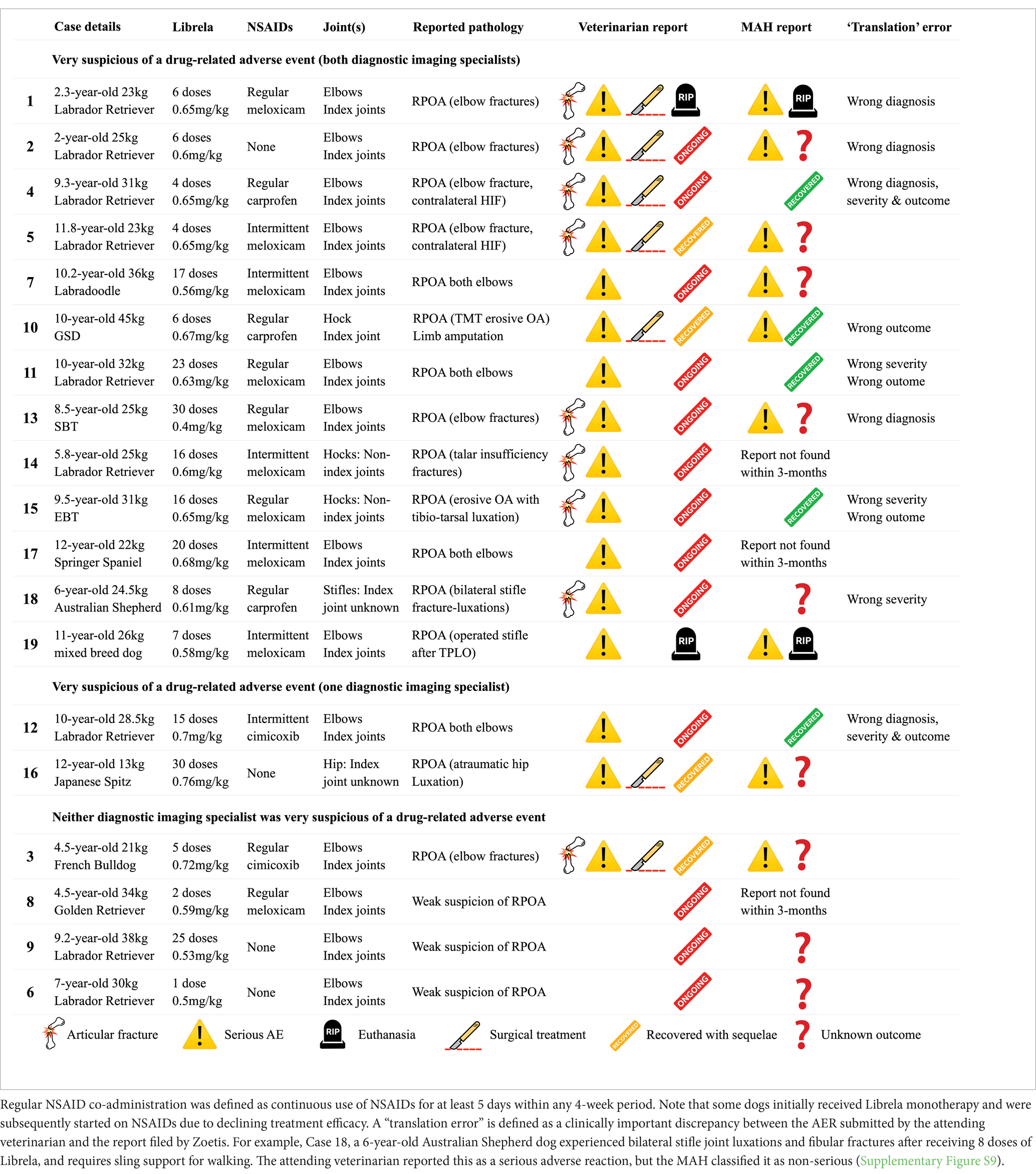
Ventitré sospetti eventi avversi muscoloscheletrici (MSAE) sono stati esaminati in modo indipendente da nove ricercatori con un’esperienza complessiva di 128 anni nella pratica clinica di riferimento (Autori 1, 5, 6, 7, 9, 11, 14, 15, 16). Sono stati valutati i dati clinici di ciascun caso, inclusi segnalamento, segni clinici, informazioni sul dosaggio di Librela, farmaci concomitanti, esiti del trattamento e risultati dei test diagnostici pertinenti (radiografie, TAC, analisi del liquido sinoviale, istopatologia). Quattro casi sono stati esclusi da ulteriori analisi a causa di dati incompleti o prove insufficienti a supporto di una relazione causale. Dodici MSAER erano già stati registrati presso l’EVD e, al momento, sono stati presentati rapporti retrospettivi per i casi rimanenti.
2.3 Giudizio sulla serie di casi
La commissione di aggiudicazione indipendente era composta da 12 chirurghi ortopedici veterinari, un consulente ortopedico specializzato in neuro-osteoartropatia umana, due specialisti in diagnostica per immagini veterinaria, due anestesisti veterinari e un ricercatore oncologo esperto in terapie basate su recettori monoclonali. La commissione ha dimostrato una competenza collettiva, con 157 pubblicazioni peer-reviewed pertinenti che spaziano tra anticorpi monoclonali, artropatia neuropatica, osteoartrite canina (OA), fratture patologiche e fessura intracondiloidea omerale (HIF).
Sono state esaminate le trascrizioni delle riunioni del Comitato consultivo per l’artrite (AAC) e del Comitato consultivo per la sicurezza e la gestione del rischio dei farmaci del 2012 e del 2021. La nostra analisi si è concentrata sulla loro revisione congiunta sulla sicurezza degli anticorpi monoclonali anti-fattore di crescita nervosa umanizzato (aNGFmAb) ( 8–10 ) . Sono state riconosciute le seguenti limitazioni negli studi clinici utilizzati per definire l’RPOA umana:
1. Immagini di base incoerenti: gli esseri umani arruolati negli studi clinici aNGFmAb sul dolore lombare che hanno sviluppato RPOA non sono stati sottoposti a immagini radiografiche di base delle articolazioni interessate prima di iniziare il trattamento ( 8 , 18 ).
2. Terminologia non specifica: la definizione di RPOA umana includeva la patologia articolare “che cade ben al di fuori della storia naturale dell’OA” ( 8 ). In particolare, questo criterio non aveva una definizione specifica della “storia naturale dell’OA” e non faceva riferimento a un gruppo di controllo con tipica progressione dell’OA.
3. Inapplicabilità della definizione umana: il termine specifico “RPOA” non è stato adottato per la nostra decisione sul caso a causa della sua dipendenza dalle misurazioni delle grandi articolazioni umane mediante radiografie in posizione eretta o risonanza magnetica ( 11 ).
Diciannove cani con sospetti MSAE a seguito di trattamento con bedinvetmab sono stati valutati indipendentemente dagli autori 3 e 4. I sospetti AE correlati al farmaco sono stati definiti secondo la metodologia dell’AAC come patologia articolare “che cade ben al di fuori della storia naturale dell’OA” ( 8 ). Ciò includeva fratture patologiche o lussazioni nelle articolazioni osteoartritiche e osteolisi subcondrale in assenza di evidenza clinica di artrite settica o immunomediata. L’accordo inter-valutatore per i due specialisti di diagnostica per immagini è stato testato utilizzando il coefficiente κ di Fleiss ( 19 ).
Le immagini diagnostiche sono state formattate e annotate dagli autori 1 e 3. Successivamente, tutti i 18 esperti hanno esaminato in modo indipendente le immagini annotate, emulando la pratica clinica standard. L’intera coorte di 19 casi è stata valutata collettivamente dal comitato di aggiudicazione per determinare la potenziale causalità del farmaco, piuttosto che valutare ogni caso individualmente, rispecchiando il protocollo AAC del 2012 ( 8 ). I lettori possono rivedere i casi guardando il video supplementare 2 .
È stato utilizzato un sistema a tre livelli per descrivere una potenziale relazione causale tra il trattamento con bedinvetmab e gli MSAE. Sono stati evitati esiti che implicassero esplicitamente un nesso causale noto (ad esempio, “sicuramente correlato”) per riflettere l’incertezza intrinseca di questa valutazione. Invece, gli esperti hanno descritto il loro giudizio personale come “molto sospetto”, “sospetto” o “prove insufficienti” di una potenziale relazione causale.
2.4 Errori di traduzione AER
Gli errori di traduzione sono stati identificati confrontando le MSAER presentate dai veterinari curanti con le corrispondenti relazioni depositate dal titolare dell’autorizzazione all’immissione in commercio. Una discrepanza clinicamente rilevante tra le relazioni è stata considerata un errore di traduzione.
3 risultati
3.1 Analisi di sproporzionalità MSAER
Tra il 20 maggio 2021 (3 mesi dopo il rilascio europeo di Librela) e il 31 dicembre 2024 sono stati identificati 4.746 MSAER. In seguito all’esclusione di 457 segnalazioni di farmaci di confronto che specificavano la co-somministrazione di Librela, sono rimasti 4.289 MSAER. Di questi, 3.755 (87,5%) sono stati attribuiti a Librela. La maggior parte degli MSAER (3.411, 79,5%) è stata esclusa a causa di diagnosi neurologiche e/o sistemiche/neoplastiche confondenti ( Video supplementare 1 ), con il risultato di una coorte finale di 878 MSAER ammissibili per l’analisi, di cui 789 (90%) attribuiti a Librela ( Tabella supplementare S1 ). La maggior parte delle segnalazioni primarie a Librela (88%) sono state inviate da veterinari e altri operatori sanitari ( Figura 1 ).
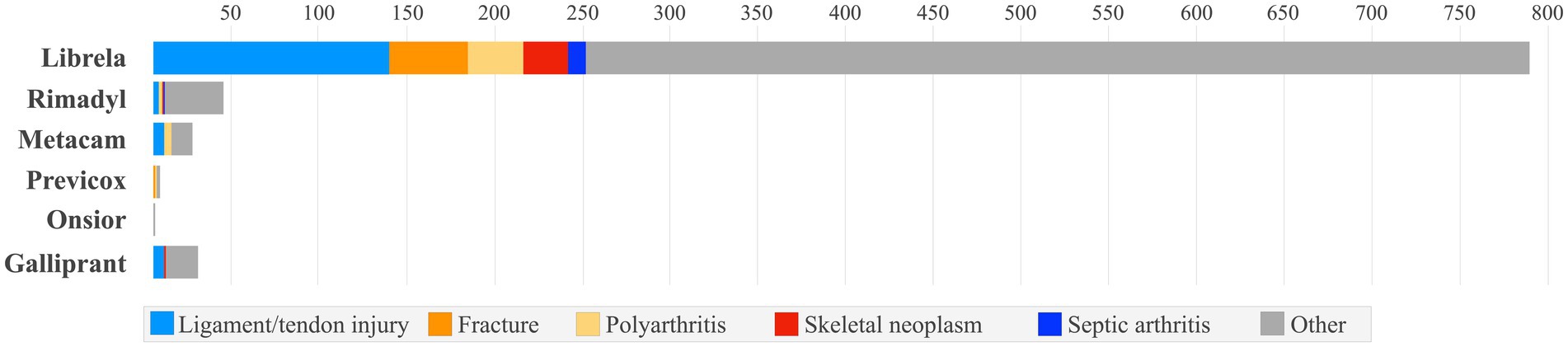
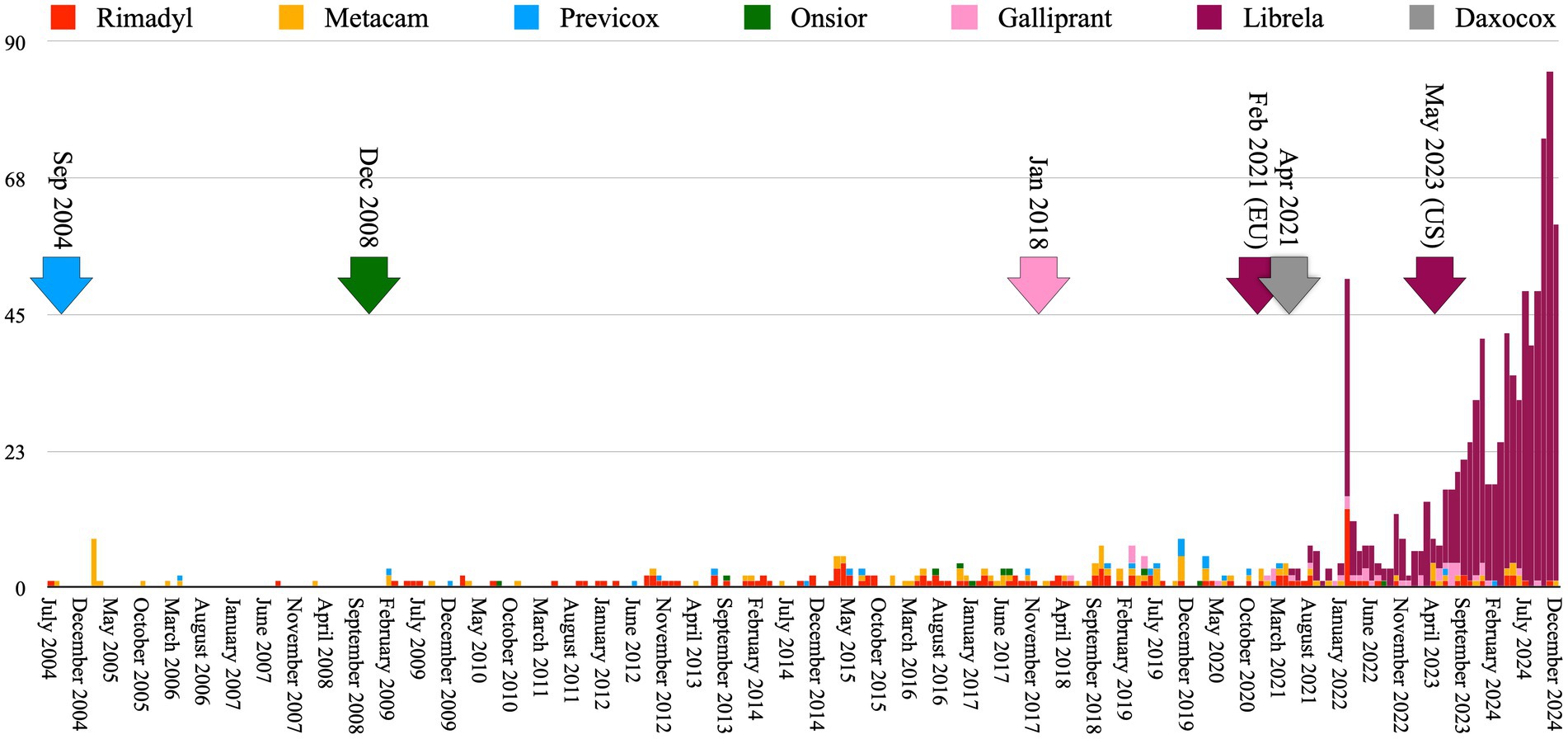
Lesioni ai legamenti/tendini, poliartrite, fratture, neoplasie muscoloscheletriche e artrite settica sono state segnalate con una frequenza circa 9 volte maggiore nei cani trattati con Librela rispetto al totale combinato dei cani trattati con i farmaci di confronto ( Figura 2 ). Inoltre, gli MSAER accumulati per Librela in 45 mesi hanno superato quelli del FANS di grado più elevato (Rimadyl) di circa 20 volte e hanno superato gli MSAER accumulati combinati di tutti i farmaci di confronto in 240 mesi di circa 3 volte ( Figura 3 ). Questi risultati non supportano l’ipotesi nulla secondo cui il tasso di MSAER di Librela non avrebbe superato quello dei farmaci di confronto di oltre il 50%. Inoltre, l’ipotesi secondaria secondo cui gli MSAER avrebbero subito un’impennata e una riduzione in seguito al lancio di nuovi farmaci non è stata supportata ( Figura 3 ).
3.2 Diagnosi e risultati specifici per gli MSAER di Librela
I termini diagnostici più frequenti selezionati dal titolare dell’autorizzazione all’immissione in commercio sono stati “artrite” o segni clinici associati (ad esempio, “zoppia”, “dolore articolare”, “difficoltà a salire le scale”), comprendenti 530 casi (67%) ( Figura 4 ). Di questi, il titolare dell’autorizzazione all’immissione in commercio ha archiviato 442 segnalazioni (83,4%) come “non gravi”. Le restanti 259 reazioni avverse al farmaco includevano lesioni ai legamenti, collasso degli arti, poliartrite, cancro alle ossa e fratture. Tra queste, il titolare dell’autorizzazione all’immissione in commercio ha archiviato 138 segnalazioni (52,3%) come “non gravi”.
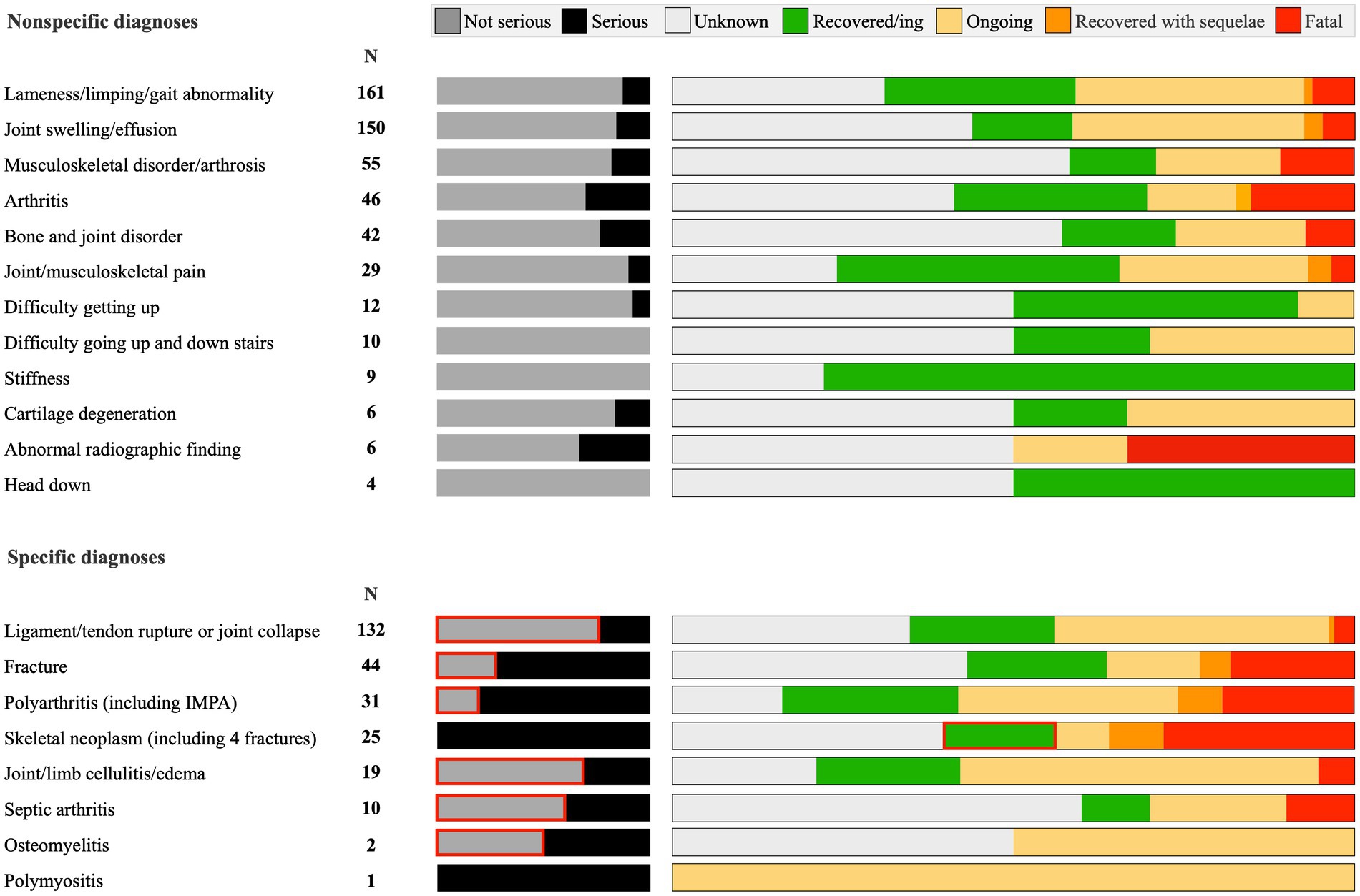
L’esito più frequentemente riportato è stato “sconosciuto” (310 cani; 39%). Dei restanti cani, 177 (22%) hanno manifestato eventi avversi (AE) segnalati come “guariti/in risoluzione/normali”; 229 (29%) sono stati registrati come “in corso”; 15 (2%) “guariti con sequele”; e 63 cani (8%) sono deceduti o sono stati soppressi.
3.3 Esito dell’aggiudicazione della serie di casi
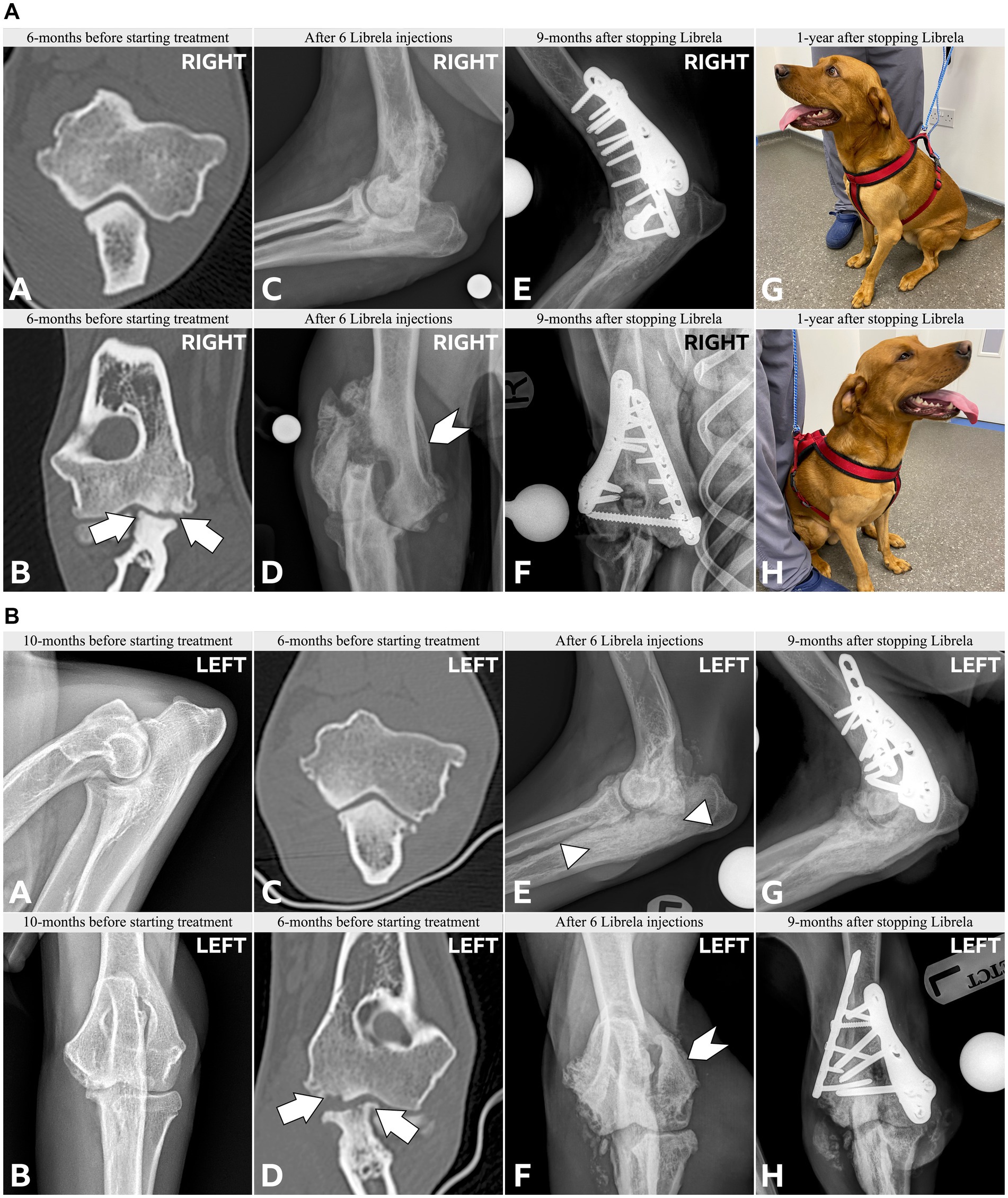
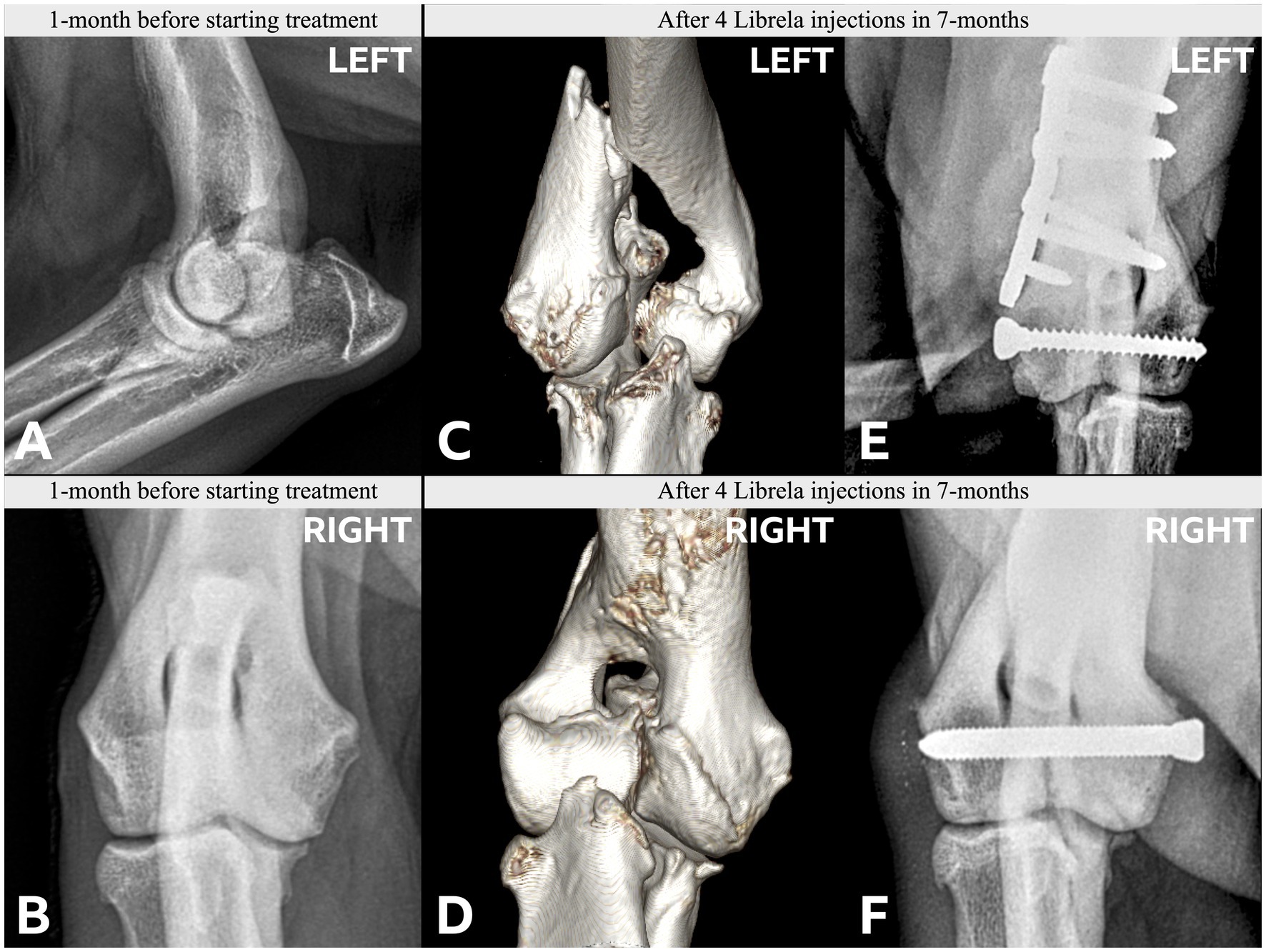
Le caratteristiche cliniche e radiografiche sono riassunte nella Tabella 2 e nelle Figure 5–13 . Il numero medio ± DS di dosi di Librela è stato di 12,7 ± 9,5 (intervallo 1–30), con un intervallo di dose di 0,4–0,76 mg/kg (media 0,62 ± 0,08 mg/kg). L’invio per accertamenti in caso di sospetta RPOA è stato effettuato almeno 6 mesi dopo l’inizio della terapia con Librela in 13/19 casi. Undici cani (58%) hanno ricevuto regolarmente FANS concomitanti. L’articolazione più frequentemente colpita è stata il gomito (13/19 cani, 68%), seguita da ginocchio e garretto (due cani ciascuno) e anca (un cane). Sette cani (37%) hanno riportato fratture patologiche e due (10,5%) hanno avuto lussazioni articolari. Due cani con articolazioni del garretto clinicamente normali prima dell’inizio della terapia con Librela hanno sviluppato una grave distruzione non indice dell’articolazione del garretto dopo il trattamento con Librela per l’artrosi del gomito.
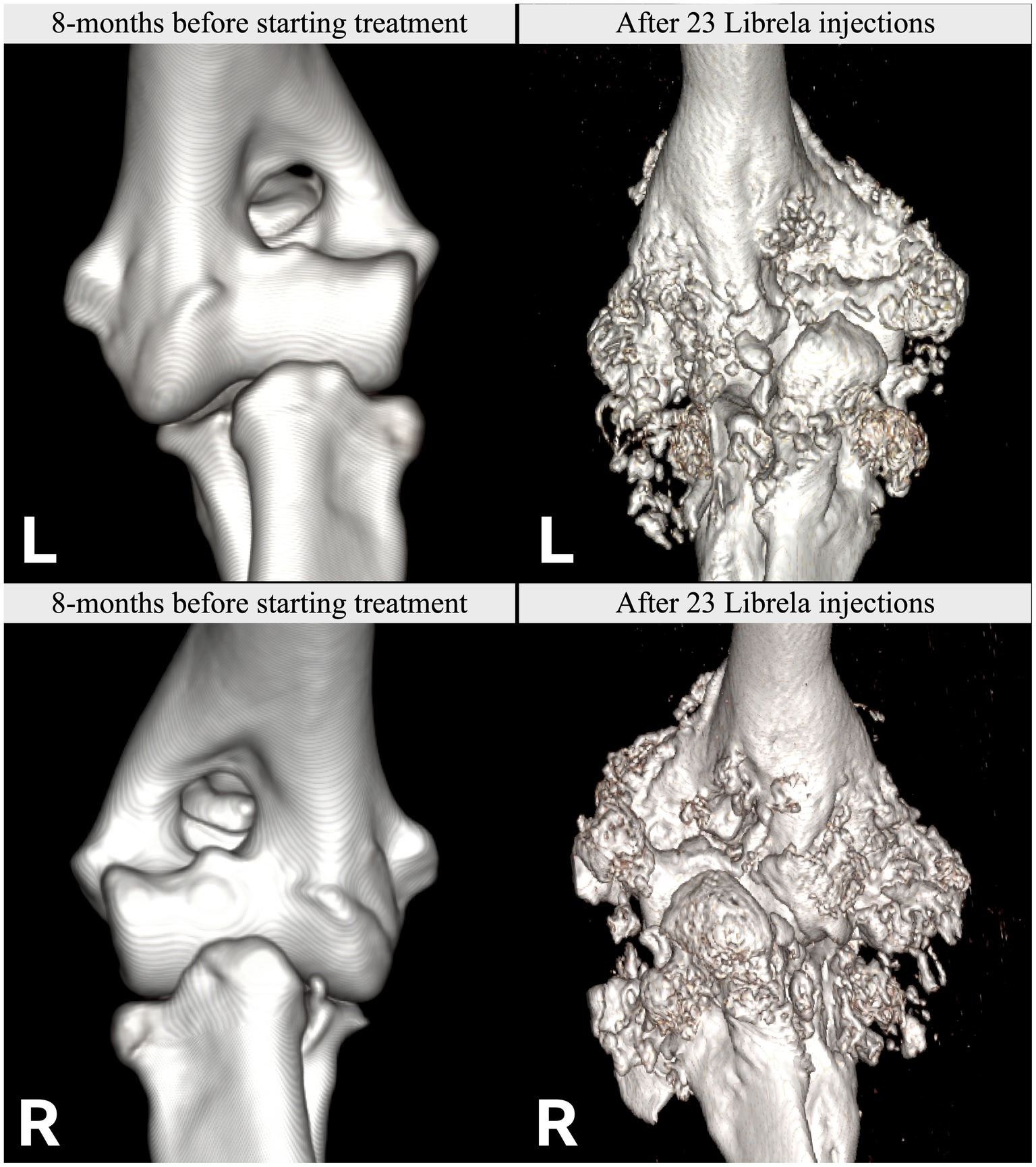
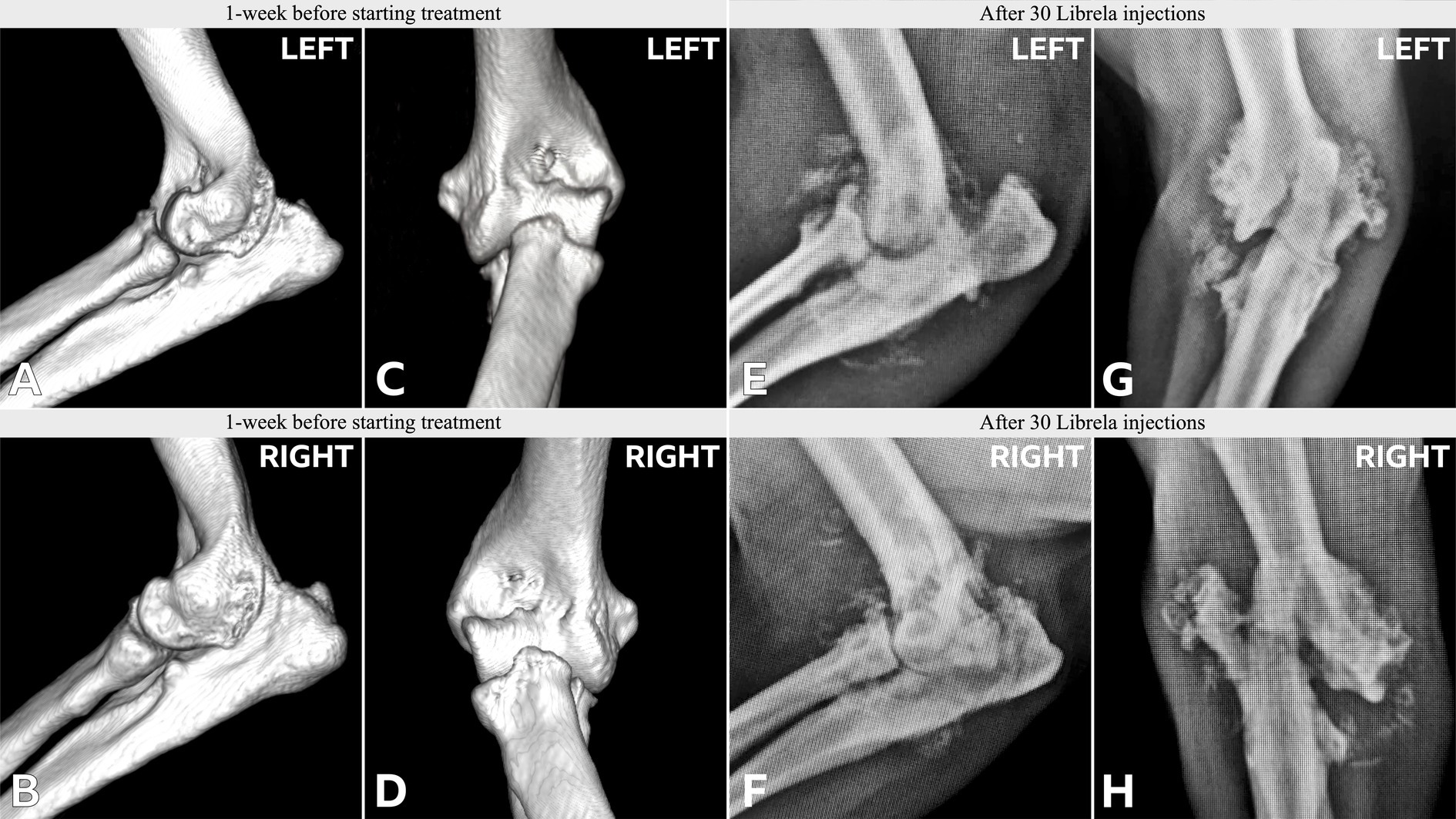
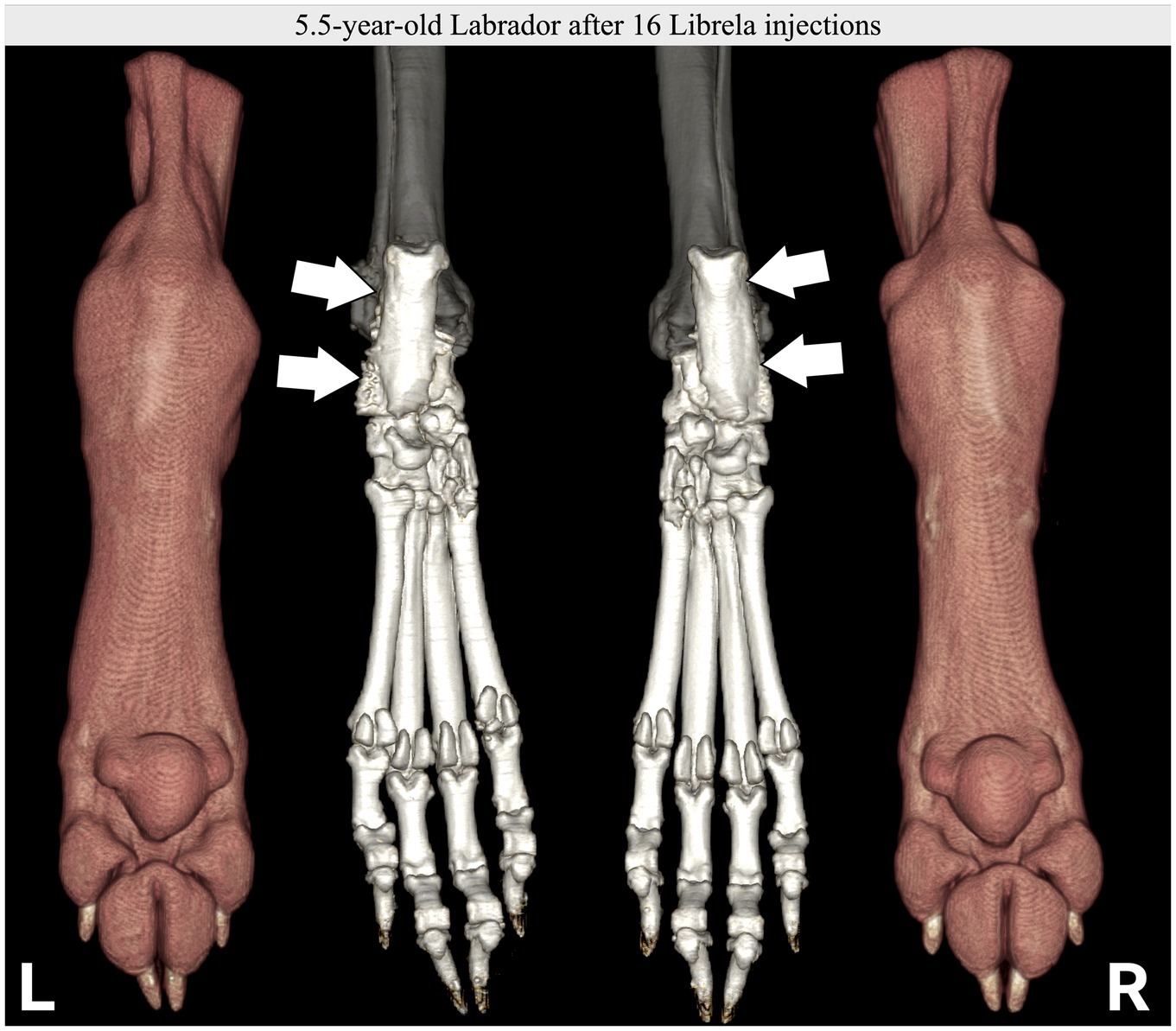
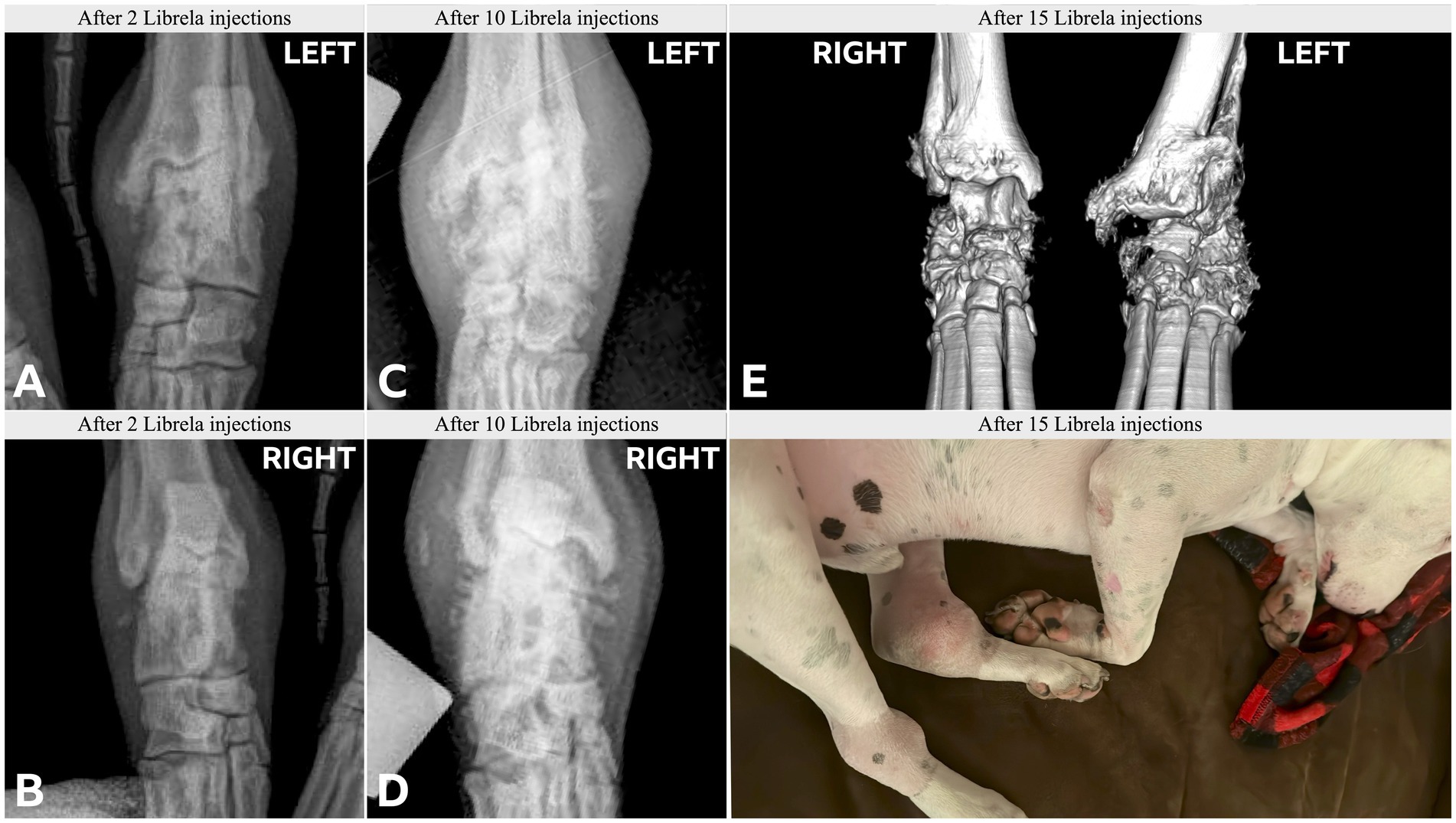
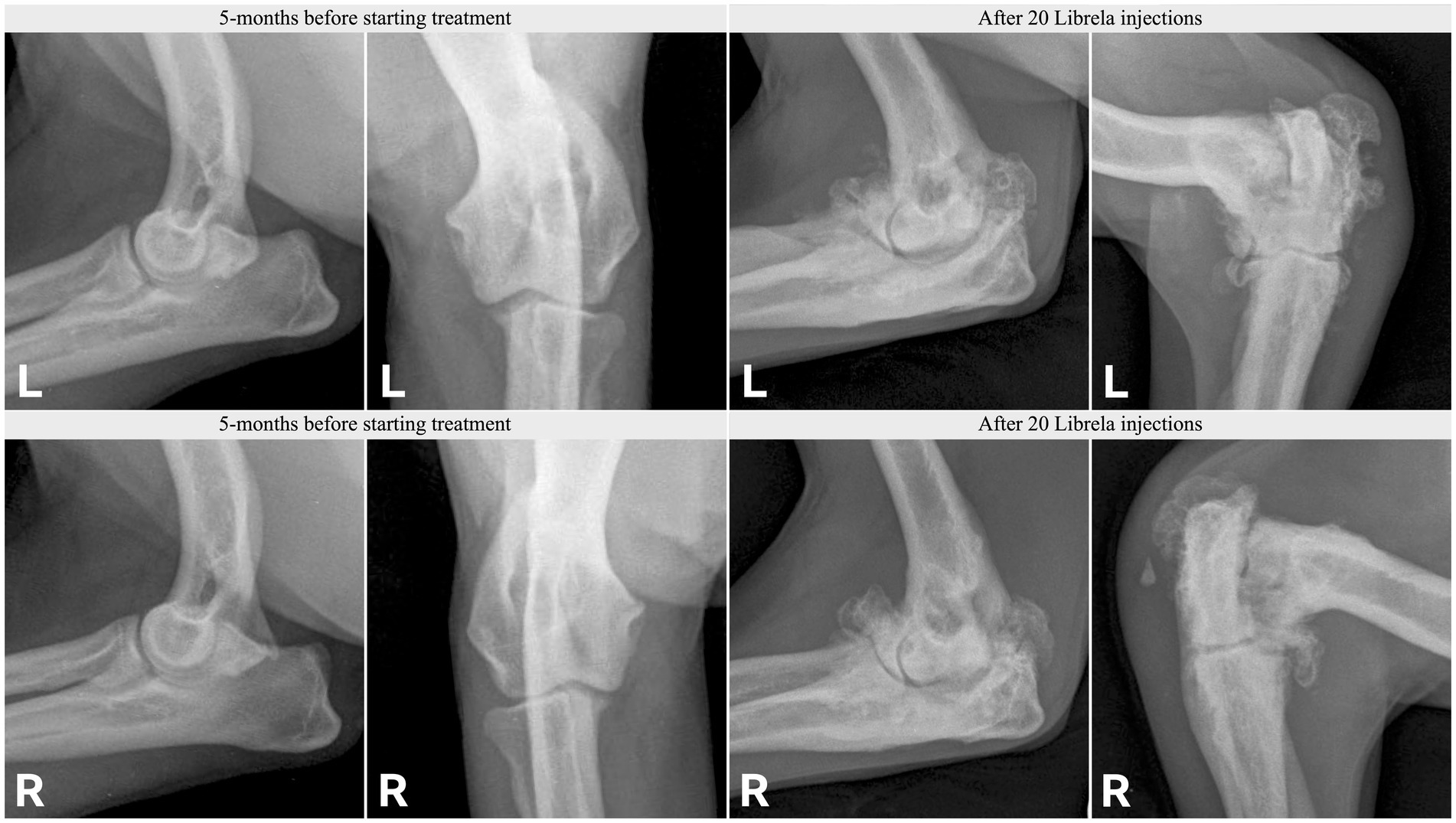
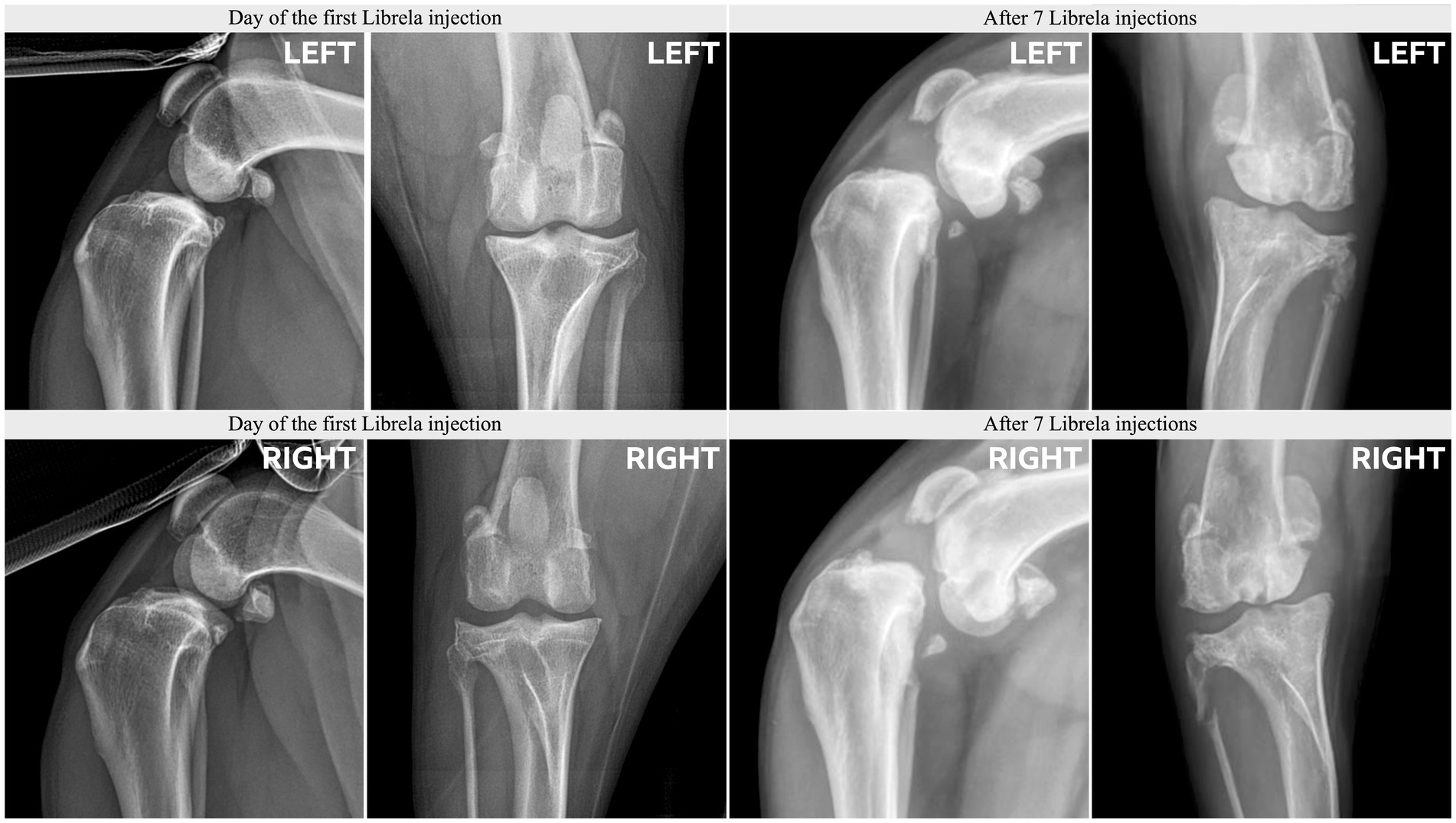
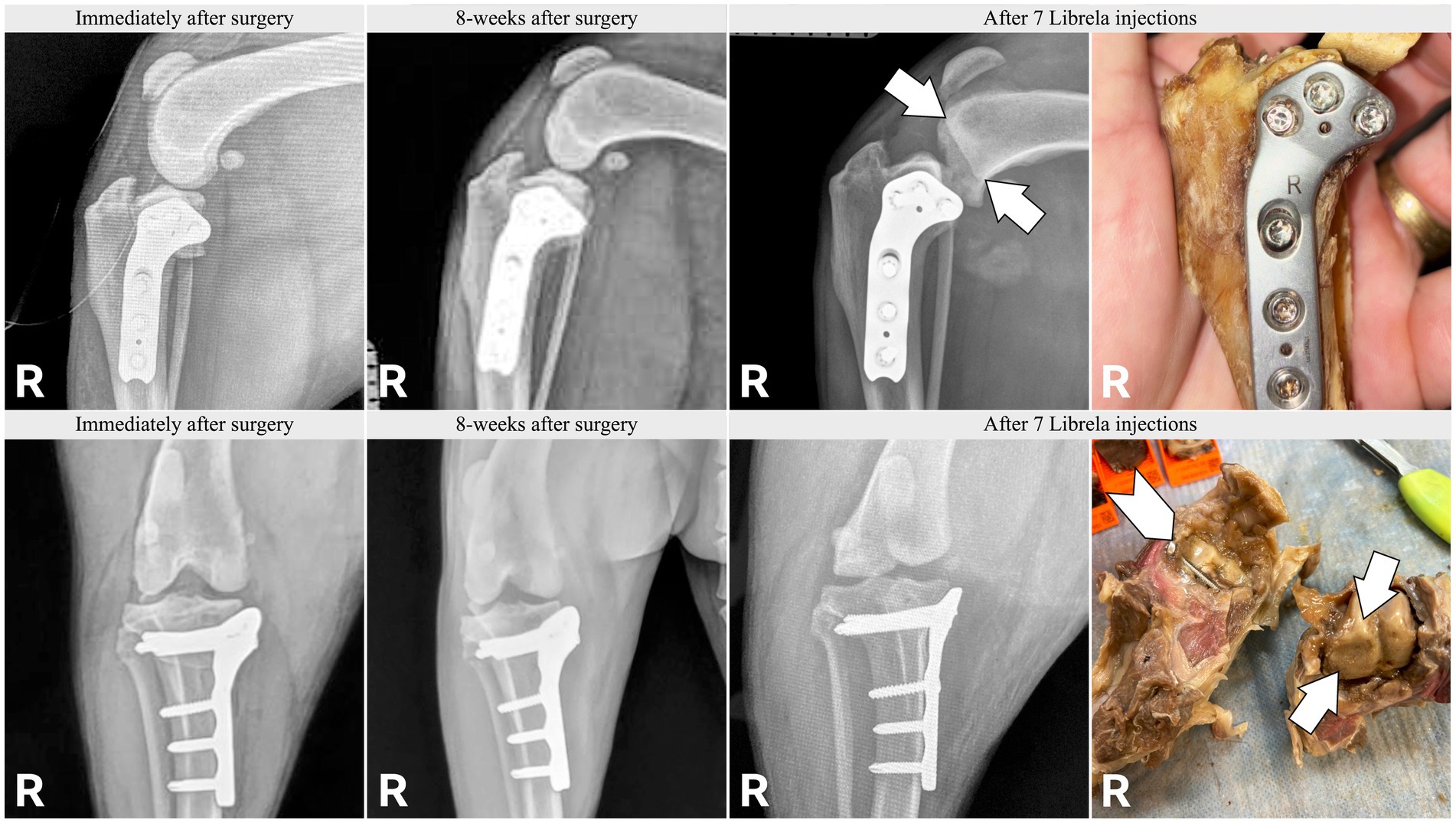
L’esame istopatologico dell’osso e del tessuto sinoviale di quattro cani non ha rivelato alcuna prova di artropatia infiammatoria, malattie trasmesse da zecche o neoplasie. Un patologo che è stato invitato a confrontare i loro risultati con quelli riportati in un articolo inviato sull’RPOA umana ( 20 ) ha commentato che le caratteristiche patologiche erano simili ( 21 ).
La concordanza interosservatore tra gli specialisti di diagnostica per immagini è stata sostanziale ( κ = 0,68, IC 95% 0,4-0,97). Entrambi gli specialisti erano molto sospettosi di una potenziale relazione causale tra la patologia osservata e il trattamento con Librela nel 68% dei cani (13/19). Inoltre, tutti i 18 membri del panel (inclusi i due esperti di diagnostica per immagini) erano molto sospettosi di una potenziale relazione causale tra il trattamento con Librela e la patologia osservata.
3.4 Errori di traduzione AER
Errori di traduzione sono stati identificati in 9/19 casi (52%) ( Tabella 2 e Figure supplementari S1 – S6 ). Tra questi rientravano diagnosi errate (n = 5), gravità (n = 5) ed esito (n = 5). Inoltre, il titolare dell’autorizzazione all’immissione in commercio ha segnalato due casi come “sovradosaggi”, nonostante i dosaggi somministrati rientrassero nell’intervallo raccomandato.
4 Discussion
Questo studio rivela una sorprendente disparità nelle segnalazioni di eventi avversi muscoloscheletrici con Librela rispetto a sei farmaci di confronto. Lesioni legamentose/tendinee, poliartrite, fratture, neoplasie muscoloscheletriche e artrite settica sono state segnalate con una frequenza nove volte maggiore nei cani trattati con Librela. È preoccupante il fatto che, dal suo lancio in Europa, Librela abbia accumulato un numero di segnalazioni 20 volte superiore rispetto al farmaco di confronto di livello più alto (Rimadyl) e tre volte superiore rispetto a tutti i farmaci di confronto combinati in un periodo di 20 anni. Inoltre, una revisione indipendente di esperti su un sottoinsieme di casi ha fortemente supportato un’associazione causale tra Librela e una distruzione articolare accelerata.
Librela ha registrato una rapida penetrazione nel mercato dopo il suo lancio europeo nel 2021. Zoetis ha recentemente riportato una distribuzione globale superiore a 21 milioni di dosi, che si traduce in una distribuzione media giornaliera stimata di oltre 15.000 dosi ( 22 ). Questo successo iniziale sul mercato è stato attenuato dalle crescenti preoccupazioni relative alla sicurezza di bedinvetmab. Queste preoccupazioni sono state amplificate da vari fattori, tra cui l’aggiornamento sulla sicurezza della FDA ( 14 ), la copertura stampa negativa ( 23 ), l’indagine della Commissione Europea su una potenziale condotta anticoncorrenziale di Zoetis ( 24 ) e l’emergere di comunità online che diffondono preoccupazioni sulla sicurezza. Questa confluenza di eventi ha favorito un clima di apprensione e confusione. Affrontare queste preoccupazioni richiede una farmacovigilanza post-marketing imparziale e rigorosa per valutare il reale profilo rischio-beneficio di questo farmaco.
Valutare l’“aspettativa” delle reazioni avverse ai farmaci (ADR) è fondamentale per un’efficace farmacovigilanza. Nelle indagini sulle relazioni causali, gli statistici utilizzano i principi bayesiani per valutare la probabilità della reazione, considerando la plausibilità e la conoscenza pregressa ( 15 ). L’ABON (Algorithm for Bayesian Onset of symptoms) della FDA collega l’esposizione al farmaco agli eventi avversi (AE) ( 15 ). Ad esempio, quando applicato ai FANS, l’ABON incorpora la conoscenza pregressa dell’inibizione delle prostaglandine, il suo effetto sull’integrità della mucosa gastrointestinale (GI) e il legame stabilito tra FANS e ulcerazione gastrointestinale ( 25 ). In particolare, i FANS possono causare danni gastrointestinali subclinici, non rilevabili senza endoscopia ( 25 ). Quando si verificano segni clinici, vomito e diarrea sono manifestazioni comuni ( 26 ). Tuttavia, la FDA non utilizza stime di prevalenza basate sui dati di vendita, perché possono sottorappresentare drasticamente la vera incidenza ( 15 ). Ad esempio, il confronto degli AER del carprofen con le vendite del farmaco suggerisce che vomito e diarrea si verificano in <1/10.000 dosi, implicando falsamente che gli effetti collaterali comuni siano “molto rari” ( 27 ).
L’analogia con i FANS è preziosa per tre ragioni. In primo luogo, mentre le prostaglandine salvaguardano l’integrità gastrointestinale, l’NGF svolge un ruolo fondamentale simile nella riparazione di ossa e cartilagine ( 5 ). In secondo luogo, una grave degenerazione subclinica della cartilagine e delle ossa spesso precede i segni clinici ( 28 ). In terzo luogo, le recenti affermazioni sugli eventi avversi (AE) “rari” o “molto rari” di bedinvetmab ( 29 ) si basano su una metodologia simile all’analisi del carprofene descritta sopra. Dati i diversi ruoli dell’NGF e le precedenti evidenze di RPOA, fratture ossee subcondrali e lussazioni articolari atraumatiche negli esseri umani e negli animali (8, 11, 30-33 ) , gli MSAE associati a bedinvetmab sono una conseguenza prevista dell’inibizione dell’NGF.
L’analisi bayesiana, sebbene potente, può essere suscettibile di distorsioni soggettive. Ciò è esemplificato dal ruolo della FDA nella crisi degli oppioidi. Pur riconoscendo il rischio intrinseco della dipendenza da oppioidi, l’agenzia si è basata eccessivamente su una lettera di cinque frasi, citata in modo sproporzionato come prova di bassi tassi di dipendenza con la terapia oppioide orale ( 34 ). La successiva caratterizzazione errata del rischio di dipendenza da parte della FDA come “minimo” è stata pesantemente criticata ( 34 ). Analogamente, l’ipotesi che l’RPOA sia un problema unicamente umano ha dovuto affrontare critiche significative. Numerosi esperti hanno contestato questa affermazione ( 32 , 35 , 36 ), citando dati di supporto deboli ( 37 ). In particolare, le affermazioni congiunte sulla sicurezza delineate nella scheda tecnica di Librela ( 38 ) si basano sulla valutazione radiografica di cinque beagle sani che hanno ricevuto la dose raccomandata ( 37 ). Questo studio ha riportato un’erosione cartilaginea “lieve” in due cani, nonostante l’erosione sia, per definizione, una forma grave di patologia cartilaginea. Inoltre, nonostante fosse stata invitata a fornire immagini annotate per chiarire questa discrepanza ( 36 ), Zoetis ha rifiutato di farlo ( 39 ).
Janssen (fulranumab), Pfizer (tanezumab) e Regeneron (fasinumab) hanno auto-segnalato una degenerazione articolare accelerata nei loro studi clinici pre-marketing sull’aNGFmab umano ( 8 ). La FDA ha risposto rapidamente e con decisione, votando 21-0 per riconoscere l’RPOA come effetto collaterale degli aNGFmAb e imponendo una sofisticata strategia di mitigazione del rischio per tutti gli studi successivi ( 8 ). La portata delle precauzioni adottate da queste aziende farmaceutiche è esemplificata dal programma tanezumab di Pfizer, che ha coinvolto 18.000 pazienti e 50.000 radiografie analizzate da 250 esperti ( 11 ).
Considerati nel contesto, i limitati studi clinici pre-marketing di bedinvetmab sollevano serie preoccupazioni. Solo 89 cani hanno ricevuto più di tre dosi ( 40 ) e, cosa fondamentale, non è stato condotto alcuno screening radiografico per la degenerazione articolare accelerata ( 40 , 41 ). A differenza di Janssen, Pfizer e Regeneron, Zoetis non è stata in grado di auto-segnalare la distruzione articolare accelerata a causa dell’assenza di indagini radiografiche. Di conseguenza, dobbiamo fare affidamento sulla sorveglianza post-marketing per determinare se gli animali da compagnia manifestano la patologia articolare avversa osservata negli esseri umani e negli animali da laboratorio trattati con aNGFmAb.
Inizialmente intendevamo pubblicare solo i 19 casi giudicati come una serie di casi. Tuttavia, abbiamo riconosciuto il potenziale rischio che casi di patologia grave venissero liquidati come casi anomali, ovvero eventi isolati sopraffatti dalle diffuse esperienze positive riportate con bedinvetmab. Data la popolarità di Librela, questa prospettiva sarebbe comprensibile. Tuttavia, questa risposta sarebbe analoga alla valutazione del rischio di danno gastrointestinale indotto da FANS confrontando l’incidenza di ulcere gastriche perforanti con i dati di vendita dei FANS. Dovrebbe essere ovvio che un tale approccio trascura il fatto cruciale che i FANS possono indurre danni subclinici non rilevabili senza esami scomodi come l’endoscopia. Fondamentalmente, a differenza della mucosa gastrointestinale, che possiede una significativa capacità rigenerativa, il danno cartilagineo, una volta insorto, è in gran parte irreversibile ( 42 ). Questa differenza fondamentale sottolinea la gravità degli MSAE associati agli aNGFmAb.
Per integrare le analisi bayesiane della FDA, che hanno raccolto dati da maggio 2023 a marzo 2024, abbiamo utilizzato una valutazione descrittiva di 20 anni di dati MSAER. Questo approccio è stato ritenuto complementare perché l’algoritmo ABON si concentra principalmente sull’identificazione delle ADR che si verificano subito dopo l’inizio del trattamento, mentre le MSAE mostrano spesso un lungo periodo di latenza tra la somministrazione del farmaco e il rilevamento dell’AE. Questa ipotesi è supportata dall’osservazione che la maggior parte delle reazioni nell’analisi della FDA si è verificata entro la prima settimana dopo l’iniezione, mentre la maggior parte delle RPOA umane ( 9 , 10 ) e 13/19 casi nel nostro studio si sono manifestati almeno 6 mesi dopo l’inizio del trattamento.
Un limite della nostra analisi descrittiva è l’intrinseca soggettività associata al giudizio degli esperti. Per mitigare potenziali bias, il comitato di valutazione era composto principalmente da veterinari con un interesse comune nel miglioramento della gestione del dolore negli animali da compagnia. È importante sottolineare che nessuno di loro aveva legami finanziari con aziende farmaceutiche veterinarie. Avendo mitigato i bias e riconoscendo l’intrinseca soggettività nell’analisi e nell’interpretazione dei dati, abbiamo dato priorità alla presentazione dei dati per facilitare il giudizio indipendente dei lettori, indipendentemente dal loro livello di competenza. Un altro limite riconosciuto del nostro studio riguarda le linee guida della FDA secondo cui il rilevamento del segnale di AE dovrebbe servire principalmente come strumento per la generazione di ipotesi . Di conseguenza, il nostro studio esplorativo è stato progettato per identificare potenziali segnali di sicurezza piuttosto che fornire un profilo di sicurezza completo. Pertanto, non può affrontare questioni specifiche come l’impatto della co-somministrazione di FANS sul rischio di MSAER. Tuttavia, riteniamo che questi risultati offrano spunti preziosi e stimoleranno ulteriori indagini.
Il nostro studio evidenzia un’importante debolezza nell’attuale sistema di farmacovigilanza: la mancanza di una terminologia completa per rilevare accuratamente gli eventi avversi gravi. L’assenza di RPOA come termine diagnostico in VeDDRA è particolarmente preoccupante, in quanto potrebbe portare a una sostanziale sottostima degli eventi avversi più gravi (MSAER). Senza un termine specifico, questi eventi potrebbero essere classificati erroneamente come manifestazioni della condizione sottostante in trattamento (ad esempio, “artrite” o “zoppia”), oscurando la reale incidenza e gravità delle ADR. Per colmare questa lacuna e migliorare la qualità dei dati, abbiamo formalmente richiesto l’aggiunta del termine “RPOA” a VeDDRA ( 16 ). La nostra definizione proposta, “patologia articolare che si colloca ben al di fuori della storia naturale dell’OA”, sfrutta l’esperienza e il giudizio clinico dei veterinari segnalanti con accesso diretto ai dati dei pazienti.
Un membro del panel della FDA coinvolto nella valutazione degli aNGFmAb umanizzati ha riassunto eloquentemente la nostra attuale convinzione: “Tutte le parti concordano sul fatto che l’uso di aNGFmAb sia efficace, ma sono associati a una forma unica di OA in rapida progressione… e possiamo solo fare ipotesi sulle sue cause ( 8 ).” Negli animali, proprio come negli esseri umani, l’obiettivo di una gestione efficace del dolore è fondamentale. Tuttavia, dobbiamo anche garantire che i nostri interventi terapeutici non aggravino inavvertitamente la condizione sottostante. Per mantenere i più alti standard di cura per gli animali da compagnia, speriamo di applicare agli mAb veterinari lo stesso rigoroso controllo impiegato nell’assistenza sanitaria umana.
Dichiarazione di disponibilità dei dati
I contributi originali presentati nello studio sono inclusi nell’articolo/ Materiale supplementare .
Contributi degli autori
MF: Concettualizzazione, Analisi formale, Indagine, Metodologia, Amministrazione del progetto, Scrittura – bozza originale, Scrittura – revisione e editing. FW: Analisi formale, Indagine, Scrittura – revisione e editing. IC: Analisi formale, Indagine, Metodologia, Supervisione, Scrittura – revisione e editing. GS: Analisi formale, Scrittura – revisione e editing. LC: Analisi formale, Risorse, Scrittura – revisione e editing. RA: Analisi formale, Supervisione, Scrittura – revisione e editing. DP: Analisi formale, Supervisione, Scrittura – revisione e editing. RS: Analisi formale, Scrittura – revisione e editing. DV: Analisi formale, Scrittura – revisione e editing. MA-V: Analisi formale, Risorse, Scrittura – revisione e editing. AP: Analisi formale, Scrittura – revisione e editing. RQ: Analisi formale, Scrittura – revisione e editing. JH: Analisi formale, Scrittura – revisione e editing. SC: Analisi formale, Scrittura – revisione e editing. CJ: Analisi formale, Scrittura – revisione e editing. MH: Analisi formale, scrittura, revisione e editing. AM: Analisi formale, scrittura, revisione e editing. MG: Analisi formale, scrittura, revisione e editing.
Finanziamento
Gli autori dichiarano di non aver ricevuto alcun sostegno finanziario per la ricerca e/o la pubblicazione del presente articolo.
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di qualsiasi rapporto commerciale o finanziario che potrebbe essere interpretato come un potenziale conflitto di interessi.
Dichiarazione di intelligenza artificiale generativa
Gli autori dichiarano che nella creazione di questo manoscritto non è stata utilizzata alcuna Gen AI.
Nota dell’editore
Tutte le affermazioni espresse in questo articolo sono esclusivamente quelle degli autori e non rappresentano necessariamente quelle delle loro organizzazioni affiliate, né quelle dell’editore, dei redattori e dei revisori. Qualsiasi prodotto che possa essere valutato in questo articolo, o qualsiasi affermazione che possa essere fatta dal suo produttore, non è garantito o avallato dall’editore.
Materiale supplementare
Il materiale supplementare per questo articolo è disponibile online all’indirizzo: https://www.frontiersin.org/articles/10.3389/fvets.2025.1581490/full#supplementary-material
VIDEO SUPPLEMENTARE 1 | Dimostrazione della strategia di ricerca MSAER del database EudraVigilance. Il database è accessibile all’indirizzo: https://www.adrreports.eu/vet/en/search.html# (consultato dal 18 al 23 settembre 2024 e dal 1 al 10 gennaio 2025).
VIDEO SUPPLEMENTARE 2 | Presentazione narrata utilizzata dal collegio giudicante indipendente.
TABELLA SUPPLEMENTARE S1 | 789 segnalazioni di eventi avversi muscoloscheletrici a Librela (maggio 2021–dicembre 2024).
FIGURA SUPPLEMENTARE S1 | Caso 1 — Errore di traduzione dell’AER. Lo specialista curante ha presentato un AER specificando il sospetto di RPOA. Il titolare dell’autorizzazione all’immissione in commercio ha presentato un rapporto con una diagnosi errata di artrite settica.
FIGURA SUPPLEMENTARE S2 | Caso 2—Errore di traduzione dell’AER. Il titolare dell’autorizzazione all’immissione in commercio ha presentato un rapporto specificando “sovradosaggio”, ma la dose somministrata (0,6 mg/kg) rientrava nell’intervallo raccomandato ( 38 ).
FIGURA SUPPLEMENTARE S3 | Caso 4 — Errore di traduzione AER. Un Labrador Retriever di 9,3 anni ha riportato una frattura patologica del gomito. Lo specialista curante ha presentato un’AER al VMD specificando il sospetto di RPOA. Questa segnalazione è stata condivisa con il titolare dell’autorizzazione all’immissione in commercio, che ha presentato una segnalazione per “artrite” non grave, con esito di guarigione/risoluzione.
FIGURA SUPPLEMENTARE S4 | Caso 10 — Errore di traduzione dell’AER. Un pastore tedesco di 10 anni ha richiesto l’amputazione di un arto posteriore per gestire l’osteoartrosi tarso-metatarsale erosiva. Lo specialista curante ha presentato un’AER al VMD, includendo il risultato dell’analisi istopatologica (compatibile con l’RPOA). Il titolare dell’autorizzazione all’immissione in commercio ha presentato un rapporto attestante la guarigione/risoluzione dell’AE a seguito di “amputazione di un dito”.
FIGURA SUPPLEMENTARE S5 | Caso 11 — Errore di traduzione dell’AER. Lo specialista curante ha presentato un’AER al VMD specificando una diagnosi di RPOA in corso. Il titolare dell’autorizzazione all’immissione in commercio ha presentato un rapporto per artrite non grave, che è stata guarita/risolta.
FIGURA SUPPLEMENTARE S6 | Caso 12—Errore di traduzione dell’AER. Lo specialista curante ha presentato un AER al VMD specificando una diagnosi di RPOA grave. Il titolare dell’autorizzazione all’immissione in commercio ha presentato un rapporto per un disturbo osseo e articolare non grave che è stato risolto/risolto. Il titolare dell’autorizzazione all’immissione in commercio ha presentato un rapporto specificando “sovradosaggio”, ma la dose somministrata (0,7 mg/kg) rientrava nell’intervallo raccomandato ( 38 ).
FIGURA SUPPLEMENTARE S7 | Caso 13 — Errore di traduzione dell’AER. Lo specialista curante ha presentato un AER specificando il sospetto di RPOA. Il titolare dell’autorizzazione all’immissione in commercio ha presentato un referto con una diagnosi errata di osteosarcoma.
FIGURA SUPPLEMENTARE S8 | Caso 15 — Errore di traduzione AER. Un Bull Terrier inglese di 9 anni e mezzo ha sviluppato artrite erosiva in articolazioni del garretto precedentemente normali. Il titolare dell’autorizzazione all’immissione in commercio ha presentato un rapporto con diagnosi di tumefazione articolare non grave, che è stata poi recuperata/risolta.
FIGURA SUPPLEMENTARE S9 | Caso 18 — Errore di traduzione dell’AER. Un pastore australiano di 6 anni ha sviluppato lussazioni bilaterali del ginocchio e fratture del perone dopo 8 dosi di Librela. Il titolare dell’autorizzazione all’immissione in commercio ha depositato un’AER che ha definito questa reazione come non grave.
Riferimenti
1. O’Neill, DG, Brodbelt, DC, Hodge, R, Church, DB e Meeson, RL. Epidemiologia e gestione clinica della patologia articolare del gomito nei cani sottoposti a cure veterinarie primarie nel Regno Unito. Canine Genet Epidemiol . (2020) 7:1. doi: 10.1186/s40575-020-0080-5
2. Barbeau-Gregoire, M., Otis, C., Cournoyer, A., Moreau, M., Lussier, B. e Troncy, E. Una revisione sistematica e meta-analisi del 2022 di diete terapeutiche arricchite e nutraceutici nell’osteoartrite canina e felina. Int J Mol Sci . (2022) 23:10384. doi: 10.3390/ijms231810384
3. Belshaw, Z, Asher, L, e Dean, RS. L’atteggiamento di proprietari e veterinari nel Regno Unito nei confronti del rischio di eventi avversi associati all’uso di farmaci antinfiammatori non steroidei (FANS) per il trattamento dell’osteoartrite nei cani. Prev Vet Med . (2016) 131:121–6. doi: 10.1016/j.prevetmed.2016.07.017
4. Anderson, KL, O’Neill, DG, Brodbelt, DC, Church, DB, Meeson, RL, Sargan, D, et al. Prevalenza, durata e fattori di rischio per l’osteoartrite appendicolare in una popolazione canina del Regno Unito sottoposta a cure veterinarie primarie. Sci Rep . (2018) 8:5641. doi: 10.1038/s41598-018-23940-z
5. Fiore, M., Chaldakov, GN, e Aloe, L. Il fattore di crescita nervoso come molecola di segnalazione per le cellule nervose e anche per il sistema neuroendocrino-immunitario. Annu Rev Neurosci . (2009) 20:133–45. doi: 10.1515/REVNEURO.2009.20.2.133
6. Hochberg, MC. Gravi eventi avversi correlati alle articolazioni in studi clinici randomizzati controllati con anticorpi monoclonali anti-fattore di crescita nervoso. Osteoarthr Cartil . (2015) 23:S18–21. doi: 10.1016/j.joca.2014.10.005
7. Hochberg, MC, Carrino, JA, Schnitzer, TJ, Guermazi, A, Walsh, DA, White, A, et al. Sicurezza ed efficacia a lungo termine del tanezumab sottocutaneo rispetto ai farmaci antinfiammatori non steroidei per l’osteoartrite dell’anca o del ginocchio: uno studio randomizzato. Arthritis Rheumatol . (2021) 73:1167–77. doi: 10.1002/art.41674
8. Comitato consultivo per l’artrite (AAC). Trascrizione della riunione. 12 marzo 2012. Disponibile online all’indirizzo: https://web.archive.org/web/20161023214450/http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/ArthritisAdvisoryCommittee/UCM307880.pdf (consultato il 26 giugno 2024).
9. Riunione congiunta dell’Arthritis Advisory Committee (AAC) e del Drug Safety and Risk Management Advisory Committee. Trascrizione della riunione. 25 marzo 2021. Disponibile online all’indirizzo: https://www.fda.gov/media/150663/download (consultato il 1° luglio 2024).
10. Riunione congiunta dell’Arthritis Advisory Committee (AAC) e del Drug Safety and Risk Management Advisory Committee. Trascrizione della riunione. 24 marzo 2021. Disponibile online all’indirizzo: https://www.fda.gov/media/150662/download (consultato il 1° luglio 2024).
11. Roemer, FW, Hochberg, MC, Carrino, JA, Kompel, AJ, Diaz, L, Hayashi, D, et al. Ruolo dell’imaging per l’idoneità e la sicurezza degli studi clinici sull’a-NGF. Ther Adv Musculoskelet Dis . (2023) 15:1–11. doi: 10.1177/1759720X231171768
12. Gliklich, RE, Dreyer, NA, e Leavy, MB. Registri per la valutazione degli esiti dei pazienti: una guida per l’utente [internet] . 3a ed. Rockville (MD): Agency for Healthcare Research and Quality (USA) (2014).
13. Dally, A. Talidomide: la tragedia era prevenibile? Lancet . (1998) 351:1197–9. doi: 10.1016/S0140-6736(97)09038-7
14. Food and Drug Administration (FDA) statunitense. La FDA informa i veterinari degli eventi avversi segnalati nei cani trattati con Librela (iniezione di bedinvetmab). Disponibile online all’indirizzo: https://www.fda.gov/animal-veterinary/product-safety-information/dear-veterinarian-letter-notifying-veterinarians-about-adverse-events-reported-dogs-treated-librela (consultato il 6 gennaio 2025).
15. Woodward, KN. Farmacovigilanza veterinaria. Parte 5. Causalità e prevedibilità. J Vet Pharmacy Ther . (2005) 28:203–11. doi: 10.1111/j.1365-2885.2005.00649.x
16. EMA. Dizionario Veterinario per gli Affari Farmaceutici (VeDDRA), elenco di termini clinici per la segnalazione di sospetti eventi avversi muscoloscheletrici associati a medicinali veterinari. Disponibile online all’indirizzo: http://justusrandolph.net/kappa/ (consultato l’11 ottobre 2024).
17. Forum privato Ortholistserv di Groups.io ospitato da groups.io. Thread di Librela, 4 settembre 2023.
18. Dimitroulas, T, Lambe, T, Raphael, JH, Kitas, GD e Duarte, RV. Farmaci biologici come analgesici per la gestione del mal di schiena e della sciatica. Pain Med . (2019) 20:1678–86. doi: 10.1093/pm/pny214
19. Randolph, JJ. Calcolatore Kappa online. Disponibile online all’indirizzo: http://justus.randolph.name/kappa (consultato il 27 settembre 2024).
20. Sono, T., Meyers, CA. Miller, D., Ding, C., McCarthy, EF. e James, AW. Caratteristiche sovrapposte dell’osteoartrosi rapidamente progressiva e dell’artropatia di Charcot. J Orthop . (2019) 16:260–4. doi: 10.1016/j.jor.2019.02.015
21. Erles, K. Gruppo di Patologia Veterinaria, Hitchin, Regno Unito. I rapporti redatti sono disponibili su richiesta.
22. Zoetis. Dichiarazione di Zoetis sulla sicurezza di Librela, 18 dicembre 2024. Disponibile online all’indirizzo: https://news.zoetis.com/press-releases/press-release-details/2024/Zoetis-Statement-on-the-Safety-of-Librela/default.aspx (consultato il 6 gennaio 2025)
23. Calfas, J. Cosa ha ucciso i loro animali domestici? I proprietari danno la colpa ai farmaci, ma i veterinari non ne sono certi. Wall Street Journal. 12 aprile 2024. Disponibile online all’indirizzo: https://www.wsj.com/health/pharma/dog-cat-arthritis-drugs-bcdddea6?st=nqd8io6pc74r71z&reflink=desktopwebshare_permalink (consultato il 10 agosto 2024)
24. Commissione Europea. La Commissione Europea avvia un’indagine su una possibile condotta anticoncorrenziale da parte di Zoetis in merito a un nuovo farmaco antidolorifico per cani. Disponibile online all’indirizzo: https://ec.europa.eu/commission/presscorner/detail/en/ip_24_1687 (consultato il 30 marzo 2024)
25. Hillier, TN, Watt, MM, Grimes, JA, Berg, AN, Heinz, JA e Dickerson, VM. I cani trattati con farmaci antinfiammatori non steroidei risparmiatori di cicloossigenasi-2 e/o steroidi non fisiologici sono a rischio di grave ulcera gastrointestinale. J Am Vet Med Assoc . (2024) 263:1–8. doi: 10.2460/javma.24.06.0430
26. Innes, JF, Clayton, J, e Lascelles, BD. Revisione della sicurezza e dell’efficacia dell’uso a lungo termine di FANS nel trattamento dell’osteoartrite canina. Vet Rec . (2010) 166:226–30. doi: 10.1136/vr.c97
27. Hunt, JR, Dean, RS, Davis, GN e Murrell, JC. Un’analisi delle frequenze relative degli eventi avversi segnalati associati alla somministrazione di FANS in cani e gatti nel Regno Unito. Vet J . (2015) 206:183–90. doi: 10.1016/j.tvjl.2015.07.025
28. Jones, GM, Pitsillides, AA, e Meeson, RL. Oltre i limiti della rilevazione: passato, presente e futuro della diagnostica per immagini nell’osteoartrite canina. Front Vet Sci . (2022) 9:789898. doi: 10.3389/fvets.2022.789898
29. Monteiro, BP, Simon, T, Knesl, O, Mandello, K, Nederveld, S, Olby, NJ, et al. Segnalazione di farmacovigilanza globale del primo anticorpo monoclonale per l’osteoartrite canina: un caso di studio con bedinvetmab (Librela™). Front Vet Sci . 12:1558222. doi: 10.3389/fvets.2025.1558222
30. Menges, S., Michaelis, M. e Kleinschmidt-Dörr, K. Il trattamento con anti-NGF peggiora le dimensioni dell’osso e della cartilagine subcondrale, migliorando al contempo i sintomi nei conigli allevati a terra con osteoartrite. Front Physiol . (2023) 14:1201328. doi: 10.3389/fphys.2023.1201328
31. LaBranche, TP, Bendele, AM, Omura, BC, Gropp, KE, Hurst, SI, Bagi, CM, et al. L’inibizione del fattore di crescita nervoso con tanezumab influenza il carico e il successivo danno cartilagineo nel modello di lesione del menisco mediale del ratto. Ann Rheum Dis . (2017) 76:295–302. doi: 10.1136/annrheumdis-2015-208913
32. Iff, I, Hohermuth, B, Bass, D, e Bass, M. Un caso di potenziale osteoartrite a rapida progressione (RPOA) in un cane durante il trattamento con bedinvetmab. Vet Anaesth Analg . 52:263–5. doi: 10.1016/j.vaa.2024.11.041
33. Berenbaum, F, Blanco, FJ, Guermazi, A, Miki, K, Yamabe, T, Viktrup, L, et al. Tanezumab sottocutaneo per l’osteoartrite dell’anca o del ginocchio: risultati di efficacia e sicurezza da uno studio randomizzato di fase III di 24 settimane con un periodo di follow-up di 24 settimane. Ann Rheum Dis . (2020) 79:800–10. doi: 10.1136/annrheumdis-2019-216296
34. deShazo, R., Johnson, M., Eriator, I., e Rodenmeyer, K. Retroscena dell’epidemia di oppioidi negli Stati Uniti: buone intenzioni finite male, un’industria che si è ribellata e guardie di sicurezza che si sono addormentate. Am J Med . (2018) 131:595–601. doi: 10.1016/j.amjmed.2017.12.045
35. Kronenberger, K. Nei cani con diagnosi di osteoartrite, quanto è sicuro ed efficace il trattamento a lungo termine con bedinvetmab nel fornire analgesia? Vet Evid . (2023) 8. doi: 10.18849/ve.v8i1.598
36. Farrell, M., Adams, R. e von Pfeil, D. Re: valutazione della sicurezza in laboratorio di bedinvetmab, un anticorpo monoclonale anti-fattore di crescita nervoso canino, nei cani. Vet J. (2024) 305:106104. doi: 10.1016/j.tvjl.2024.106104
37. Krautmann, M., Walters, R., Cole, P., Tena, J., Bergeron, LM., Messamore, J., et al. Valutazione della sicurezza in laboratorio di bedinvetmab, un anticorpo monoclonale anti-fattore di crescita nervoso canino, nei cani. Vet J. (2021) 276:105733. doi: 10.1016/j.tvjl.2021.105733
38. Scheda tecnica di Librela US. Disponibile online all’indirizzo: https://www.zoetisus.com/content/_assets/docs/vmips/package-inserts/librela-prescribing-information.pdf (consultato il 28 settembre 2024).
39. Werts, A., Reece, D., Simon, T. e Cole, P. Re: valutazione della sicurezza in laboratorio di bedinvetmab, un anticorpo monoclonale anti-fattore di crescita nervoso canino, nei cani. The Vet J. (2024) 306:106175. doi: 10.1016/j.tvjl.2024.106175
40. Corral, MJ, Moyaert, H, Fernandes, T, Escalada, M, Tena, JK, Walters, RR, et al. Studio clinico prospettico, randomizzato, in cieco, controllato con placebo, multicentrico su bedinvetmab, un anticorpo monoclonale canino diretto contro il fattore di crescita nervoso, in cani con osteoartrite. Vet Anaesth Analg . (2021) 48:943–55. doi: 10.1016/j.vaa.2021.08.001
41. Michels, GM, Honsberger, NA, Walters, RR, Tena, JK e Cleaver, DM. Studio prospettico, randomizzato, in doppio cieco, controllato con placebo, multicentrico, a gruppi paralleli, condotto negli Stati Uniti d’America su cani con osteoartrite per valutare bedinvetmab, un anticorpo monoclonale anti-fattore di crescita nervoso canino. Vet Anaesth Analg . (2023) 50:446–58. doi: 10.1016/j.vaa.2023.06.003
42. Heinemeier, KM, Schjerling, P, Heinemeier, J, Møller, MB, Krogsgaard, MR, Grum-Schwensen, T, et al. La datazione al radiocarbonio rivela un ricambio minimo di collagene sia nella cartilagine umana sana che in quella osteoartritica. Sci Transl Med . (2016) 8:346ra90-346ra90. doi: 10.1126/scitranslmed.aad8335
43. Agenzia Europea per i Medicinali. Flusso di informazioni nel sistema di farmacovigilanza. Disponibile online all’indirizzo: https://www.ema.europa.eu/en/documents/scientific-guideline/vich-gl24-guideline-pharmacovigilance-veterinary-medicinal-products-management-adverse-event-reports-aers_en.pdf (consultato l’8 gennaio 2025).
44. VMD Connect. Disponibile online all’indirizzo: https://www.vmdconnect.uk/adverse-events (consultato l’11 luglio 2024).
Glossario
ADR – Reazione avversa al farmaco
AE – evento avverso
AER – segnalazione di eventi avversi
aNGFmAb – anticorpo monoclonale anti-NGF
TC – tomografia computerizzata
EVD – Banca dati EudraVigilance
EEBVS – Consiglio europeo di specializzazione veterinaria
EMA – Agenzia europea per i medicinali
FDA – Amministrazione per gli alimenti e i farmaci
HCF – frattura del condilo omerale
HIF – fessura intracondiloidea omerale
Titolare dell’autorizzazione all’immissione in commercio
Risonanza magnetica – risonanza magnetica per immagini
MCP – processo coronoideo mediale
MSAE – evento avverso muscoloscheletrico
MSAER – segnalazione di eventi avversi muscoloscheletrici
NGF – fattore di crescita nervosa
FANS – farmaci antinfiammatori non steroidei
OA – osteoartrite
RPOA – osteoartrite rapidamente progressiva
REMS – strategia di valutazione e mitigazione del rischio
TPLO – osteotomia di livellamento del piatto tibiale
VeDDRA – Dizionario veterinario per le reazioni avverse correlate ai farmaci
VMD – Direzione dei medicinali veterinari
Parole chiave: bedinvetmab, Librela, NGF, osteoartrite rapidamente progressiva, RPOA, distruzione articolare accelerata
Citazione: Farrell M, Waibel FWA, Carrera I, Spattini G, Clark L, Adams RJ, Von Pfeil DJF, De Sousa RJR, Villagrà DB, Amengual-Vila M, Paviotti A, Quinn R, Harper J, Clarke SP, Jordan CJ, Hamilton M, Moores AP e Greene MI (2025) Muscoloskeletal avverse events in dogs getting bedinvetmab (Librela). Fronte. Veterinario. Sci . 12:1581490. doi: 10.3389/fvets.2025.1581490
Modificato da:
Ismael Hernández Avalos , Università Nazionale Autonoma del Messico, Messico
Recensito da:
Tania Perez Jimenez , Washington State University, Stati Uniti
Agatha Elisa Miranda Cortés , Università Nazionale Autonoma del Messico, Messico
Copyright © 2025 Farrell, Waibel, Carrera, Spattini, Clark, Adams, Von Pfeil, De Sousa, Villagrà, Amengual-Vila, Paviotti, Quinn, Harper, Clarke, Jordan, Hamilton, Moores e Greene. Questo è un articolo open access distribuito secondo i termini della licenza Creative Commons Attribution (CC BY) . L’uso, la distribuzione o la riproduzione in altri forum sono consentiti, a condizione che vengano citati gli autori originali e i titolari del copyright e che venga citata la pubblicazione originale su questa rivista, in conformità con la prassi accademica accettata. Non sono consentiti usi, distribuzioni o riproduzioni che non siano conformi a questi termini.
*Corrispondenza: Mike Farrell, vetlessons@gmail.com ; Ines Carrera, inescarrerayanez@gmail.com ; Louise Clark, louise.clark@vetspecialists.co.uk
Disclaimer: Tutte le affermazioni espresse in questo articolo sono esclusivamente quelle degli autori e non rappresentano necessariamente quelle delle loro organizzazioni affiliate, né quelle dell’editore, dei redattori e dei revisori. Qualsiasi prodotto che possa essere valutato in questo articolo o qualsiasi affermazione che possa essere fatta dal suo produttore non è garantita o approvata dall’editore.







